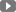Mục lục
MIRCERA là thuốc kê đơn được sử dụng cho thiếu máu do bệnh thận mãn tính và liên quan đến các triệu chứng điển hình, chẳng hạn như mệt mỏi, suy nhược và khó thở.
Dạng trình bày
MIRCERA 30 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
MIRCERA 40 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
MIRCERA 50 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
MIRCERA 60 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
MIRCERA 75 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
MIRCERA 100 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
MIRCERA 120 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
MIRCERA 150 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
MIRCERA 200 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
MIRCERA 250 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
MIRCERA 360 microgam / dung dịch 0,6 ml để tiêm trong ống tiêm chứa đầy
Dạng đăng kí
Thuốc kê đơn
Thành phần
Dược chất
MIRCERA 30 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
Một ống tiêm chứa đầy có chứa 30 microgam methoxy polyethylen glycol-epoetin beta * ở nồng độ 100 microgam / ml
MIRCERA 40 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
Một ống tiêm chứa đầy có chứa 40 microgam methoxy polyethylen glycol-epoetin beta * ở nồng độ 133 microgam / ml.
MIRCERA 50 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
Một ống tiêm chứa đầy có chứa 50 microgam methoxy polyethylen glycol-epoetin beta * ở nồng độ 167 microgam / ml.
MIRCERA 60 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
Một ống tiêm chứa đầy có chứa 60 microgam methoxy polyethylen glycol-epoetin beta * ở nồng độ 200 microgam / ml.
MIRCERA 75 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
Một ống tiêm chứa đầy có chứa 75 microgam methoxy polyethylen glycol-epoetin beta * ở nồng độ 250 microgam / ml
MIRCERA 100 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
Một ống tiêm chứa đầy có chứa 100 microgam methoxy polyethylen glycol-epoetin beta * ở nồng độ 333 microgam / ml.
MIRCERA 120 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
Một ống tiêm chứa đầy có chứa 120 microgam methoxy polyethylen glycol-epoetin beta * ở nồng độ 400 microgam / ml.
MIRCERA 150 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
Một ống tiêm chứa đầy có chứa 150 microgam methoxy polyethylen glycol-epoetin beta * ở nồng độ 500 microgam / ml.
MIRCERA 200 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
Một ống tiêm chứa đầy có chứa 200 microgam methoxy polyethylen glycol-epoetin beta * ở nồng độ 667 microgam / ml
MIRCERA 250 microgam / dung dịch 0,3 ml để tiêm trong ống tiêm chứa đầy
Một ống tiêm chứa đầy có chứa 250 microgam methoxy polyethylen glycol-epoetin beta * ở nồng độ 833 microgam / ml.
MIRCERA 360 microgam / dung dịch 0,6 ml để tiêm trong ống tiêm chứa đầy
Một ống tiêm chứa đầy có chứa 360 microgam methoxy polyethylen glycol-epoetin beta * ở nồng độ 600 microgam / ml.
Độ mạnh cho biết số lượng protein của phân tử beta methoxy polyethylen glycol-epoetin mà không xem xét quá trình glycosyl hóa.
* Protein được sản xuất bằng công nghệ DNA tái tổ hợp trong các tế bào Hamster Buồng trứng (CHO) của Trung Quốc và liên kết cộng hóa trị với một methoxy-polyethylen glycol (PEG) tuyến tính.
Hiệu lực của methoxy polyethene glycol-epoetin beta không nên được so sánh với tiềm năng của một loại protein pegylated hoặc không pegylated khác cùng loại.
Tá dược
Natri dihydrogen phosphate monohydrate
Natri sunfat
Mannit (E421)
Methionin
Poloxamer 188
Nước cất pha tiêm
Dược lực học
Cơ chế hoạt động
MIRCERA kích thích tạo hồng cầu bằng cách tương tác với thụ thể erythropoietin trên các tế bào tiền thân trong tủy xương. Methoxy polyethylene glycol-epoetin beta, các hoạt chất của MIRCERA, là một erythropoietin thụ thể hoạt hóa liên tục các chương trình một hoạt động khác nhau ở mức độ thụ thể đặc trưng bởi một hiệp hội chậm hơn và nhanh hơn phân ly từ các thụ thể, một hoạt động cụ thể giảm trong ống nghiệm với một tăng hoạt động in vivo , cũng như thời gian bán hủy tăng, trái ngược với erythropoietin. Khối lượng phân tử trung bình là khoảng 60 kDa, trong đó phần protein cộng với phần carbohydrate cấu thành khoảng 30 kDa.
Tác dụng dược lực học
Là yếu tố tăng trưởng chính cho sự phát triển của hồng cầu, hormone tự nhiên erythropoietin được sản xuất trong thận và được giải phóng vào máu để đáp ứng với tình trạng thiếu oxy. Để đáp ứng với tình trạng thiếu oxy, hormone tự nhiên erythropoietin tương tác với các tế bào tiền thân erythroid để tăng sản xuất hồng cầu.
Dược động học
Dược động học của methoxy polyethylen glycol-epoetin beta được nghiên cứu ở những tình nguyện viên khỏe mạnh và ở những bệnh nhân thiếu máu mắc bệnh CKD bao gồm cả bệnh nhân chạy thận nhân tạo và không chạy thận nhân tạo.
Sau khi tiêm dưới da cho bệnh nhân CKD không được lọc máu, nồng độ tối đa trong huyết thanh của methoxy polyethylen glycol-epoetin được theo dõi sau 95 giờ (giá trị trung bình) sau khi dùng. Sinh khả dụng tuyệt đối của methoxy polyethylen glycol-epoetin beta sau khi tiêm dưới da là 54%. Thời gian bán hủy của thiết bị đầu cuối được quan sát là 142 giờ ở bệnh nhân CKD không chạy thận nhân tạo.
Sau khi tiêm dưới da cho bệnh nhân CKD khi lọc máu, nồng độ tối đa trong huyết thanh của methoxy polyethylen glycol-epoetin beta được theo dõi 72 giờ (giá trị trung bình) sau khi dùng. Sinh khả dụng tuyệt đối của methoxy polyethylen glycol-epoetin beta sau khi tiêm dưới da là 62% và thời gian bán hủy quan sát ở giai đoạn cuối là 139 giờ ở bệnh nhân CKD khi chạy thận.
Sau khi tiêm tĩnh mạch cho bệnh nhân CKD khi lọc máu, tổng độ thanh thải toàn thân là 0,494 ml / giờ mỗi kg. Thời gian bán hủy sau khi tiêm tĩnh mạch methoxy polyethylen glycol-epoetin là 134 giờ.
So sánh nồng độ trong huyết thanh của methoxy polyethylen glycol-epoetin được đo trước và sau khi chạy thận nhân tạo ở 41 bệnh nhân CKD cho thấy chạy thận nhân tạo không có tác dụng lên dược động học của sản phẩm thuốc này.
Một phân tích ở 126 bệnh nhân CKD cho thấy không có sự khác biệt về dược động học giữa bệnh nhân chạy thận nhân tạo và bệnh nhân không chạy thận nhân tạo.
Trong một nghiên cứu liều duy nhất, sau khi tiêm tĩnh mạch, dược động học của methoxy polyethylen glycol-epoetin beta tương tự ở những bệnh nhân bị suy gan nặng so với các đối tượng khỏe mạnh
Chỉ định
Thiếu máu do bệnh thận mãn tính của bạn và liên quan đến các triệu chứng điển hình, chẳng hạn như mệt mỏi, yếu và khó thở. Điều này có nghĩa là bạn có quá ít tế bào hồng cầu và mức độ huyết sắc tố của bạn quá thấp (cơ thể của bạn các mô có thể không nhận đủ oxy).
MIRCERA được chỉ định để chỉ điều trị thiếu máu có triệu chứng do bệnh thận mãn tính. Nó là việc sử dụng chỉ giới hạn ở bệnh nhân trưởng thành (từ 18 tuổi trở lên).
MIRCERA là một loại thuốc được sản xuất bởi công nghệ gen. Giống như hoocmon tự nhiên erythropoietin, MIRCERA làm tăng số lượng tế bào hồng cầu và mức độ huyết sắc tố trong máu của bạn.
Chống chỉ định
Quá mẫn cảm với hoạt chất hoặc với bất kỳ tá dược nào được liệt kê.
Tăng huyết áp không kiểm soát.
Liều và cách dùng
Luôn luôn sử dụng thuốc này chính xác như bác sĩ đã nói với bạn. Kiểm tra với bác sĩ hoặc dược sĩ của bạn nếu bạn không chắc chắn.
Bác sĩ sẽ sử dụng liều thấp nhất có hiệu quả để kiểm soát các triệu chứng thiếu máu của bạn.
Nếu bạn không đáp ứng đầy đủ với MIRCERA, bác sĩ sẽ kiểm tra liều của bạn và sẽ thông báo cho bạn nếu bạn cần thay đổi liều MIRCERA.
Điều trị bằng MIRCERA phải được bắt đầu dưới sự giám sát của chuyên gia chăm sóc sức khỏe.
Tiêm thêm có thể được đưa ra bởi một chuyên gia chăm sóc sức khỏe hoặc, sau khi bạn đã được đào tạo, bạn có thể tự tiêm MIRCERA
MIRCERA có thể được tiêm dưới da ở bụng, cánh tay hoặc đùi; hoặc vào tĩnh mạch. Bác sĩ của bạn sẽ quyết định cái nào là tốt nhất cho bạn
Bác sĩ sẽ tiến hành xét nghiệm máu thường xuyên để theo dõi tình trạng thiếu máu của bạn đang đáp ứng với điều trị như thế nào bằng cách đo mức độ huyết sắc tố của bạn.
• Nếu bạn hiện không được điều trị bằng ESA ( thuốc kích thích tạo hồng cầu )
Nếu bạn không chạy thận nhân tạo, liều khởi đầu được khuyến nghị của MIRCERA là 1,2 microgam cho mỗi Kilôgam trọng lượng cơ thể của bạn sẽ được tiêm dưới da mỗi tháng một lần dưới dạng tiêm một lần.
Ngoài ra, bác sĩ có thể quyết định dùng liều khởi đầu MIRCERA là 0,6 microgam cho mỗi kg trọng lượng cơ thể của bạn. Liều dùng sẽ được tiêm mỗi hai tuần một lần tiêm đơn dưới da hoặc vào tĩnh mạch. Khi tình trạng thiếu máu của bạn được khắc phục, bác sĩ có thể thay đổi. liều dùng của bạn để một lần một tháng quản lý.
Nếu bạn đang lọc máu, liều khởi đầu được đề nghị là 0,6 microgam cho mỗi kg của bạn trọng lượng cơ thể. Liều được tiêm mỗi hai tuần một lần dưới dạng tiêm một lần dưới da hoặc vào tĩnh mạch. Khi tình trạng thiếu máu của bạn được khắc phục, bác sĩ có thể thay đổi liều dùng của bạn mỗi tháng một lần .
Bác sĩ của bạn có thể tăng hoặc giảm liều hoặc tạm thời ngừng điều trị để điều chỉnh mức độ huyết sắc tố, khi thích hợp cho bạn. Thay đổi liều sẽ không được thực hiện hơn một lần tháng.
• Nếu bạn hiện đang được điều trị bằng ESA ( thuốc kích thích tạo hồng cầu )
Bác sĩ có thể thay thế thuốc hiện tại của bạn bằng MIRCERA. Bác sĩ sẽ quyết định điều trị cho bạn với MIRCERA được dùng dưới dạng tiêm một lần mỗi tháng. Bác sĩ sẽ tính toán liều của bạn
Liều khởi đầu MIRCERA dựa trên liều thuốc cuối cùng của bạn. Liều MIRCERA đầu tiên sẽ được đưa ra vào ngày tiêm theo kế hoạch của thuốc trước đó của bạn.
Bác sĩ của bạn có thể tăng hoặc giảm liều hoặc tạm thời ngừng điều trị để điều chỉnh huyết sắc tố đến một mức độ thích hợp cho bạn. Thay đổi liều sẽ không được thực hiện hơn một lần tháng.
Nếu bạn quên sử dụng MIRCERA
Nếu bạn bỏ lỡ một liều MIRCERA quản lý liều đã quên ngay khi bạn nhớ và nói chuyện với Bác sĩ về khi nào nên dùng liều tiếp theo.
Nếu bạn ngừng sử dụng MIRCERA
Điều trị bằng MIRCERA thường là lâu dài. Tuy nhiên, nó có thể được dừng lại theo lời khuyên của bạn bác sĩ bất cứ lúc nào
Nếu bạn có bất kỳ câu hỏi nào về việc sử dụng thuốc này, hãy hỏi bác sĩ hoặc dược sĩ của bạn.
Chú ý đề phòng và thận trọng
Sự an toàn và hiệu quả của liệu pháp MIRCERA trong các chỉ định khác, bao gồm thiếu máu ở bệnh nhân mắc ung thư, chưa được thiết lập.
Trước khi điều trị với MIRCERA
• Một tình trạng gọi là Bất sản hồng cầu nguyên chất (PRCA, ngừng hoặc giảm sản xuất máu đỏ tế bào) do kháng thể chống erythropoietin đã được quan sát thấy ở một số bệnh nhân được điều trị bằng Các tác nhân kích thích tạo hồng cầu (ESAs), bao gồm MIRCERA. Nếu bác sĩ nghi ngờ hoặc xác nhận rằng bạn có các kháng thể này trong máu, bạn không được được điều trị bằng MIRCERA.
• Nếu bạn là bệnh nhân bị viêm gan C và bạn nhận được interferon và ribavirin, bạn nên thảo luận điều này với bác sĩ của bạn vì sự kết hợp ESA với interferon và ribavirin đã dẫn đến một mất tác dụng và sự phát triển của PRCA, một dạng thiếu máu nghiêm trọng, trong những trường hợp hiếm gặp. ESA không phê duyệt trong quản lý thiếu máu liên quan đến viêm gan C.
• Nếu bạn là bệnh nhân mắc bệnh thận mãn tính và thiếu máu được điều trị bằng ESA và cũng một bệnh nhân ung thư bạn nên biết rằng ESA, có thể có tác động tiêu cực đến bạn điều kiện. Bạn nên thảo luận về các lựa chọn điều trị thiếu máu với bác sĩ của bạn.
• Người ta không biết liệu MIRCERA có tác dụng khác nhau ở những bệnh nhân mắc bệnh tan máu bẩm sinh (rối loạn liên quan đến huyết sắc tố bất thường), chảy máu trong quá khứ hoặc hiện tại, co giật hoặc với một số lượng tiểu cầu trong máu cao. Nếu bạn có bất kỳ điều kiện nào trong số này, bác sĩ sẽ thảo luận với bạn và phải đối xử với bạn một cách thận trọng.
• Người khỏe mạnh không nên sử dụng MIRCERA. Sử dụng nó có thể dẫn đến nồng độ hemoglobin quá cao và gây ra các vấn đề về tim hoặc mạch máu có thể đe dọa tính mạng.
Trong quá trình điều trị với MIRCERA
• Nếu bạn là bệnh nhân bị suy thận mãn tính, và đặc biệt nếu bạn không đáp ứng đúng với MIRCERA, bác sĩ sẽ kiểm tra liều MIRCERA của bạn vì liên tục tăng liều MIRCERA nếu bạn không đáp ứng với điều trị có thể làm tăng nguy cơ mắc bệnh vấn đề về tim hoặc mạch máu và có thể làm tăng nguy cơ nhồi máu cơ tim, đột quỵ .
• Bác sĩ của bạn có thể bắt đầu điều trị bằng MIRCERA nếu mức huyết sắc tố của bạn là 10 g / dl (6,21 mmol / l) hoặc ít hơn. Sau khi bắt đầu trị liệu, bác sĩ sẽ tìm cách duy trì mức huyết sắc tố trong khoảng từ 10 đến 12 g / dl (7,45 mmol / l).
• Bác sĩ sẽ kiểm tra lượng sắt trong máu của bạn trước và trong MIRCERA sự đối xử. Nếu số lượng quá thấp, bác sĩ có thể cung cấp cho bạn một chất bổ sung sắt.
• Bác sĩ sẽ kiểm tra huyết áp của bạn trước và trong khi điều trị MIRCERA. Nếu huyết áp của bạn cao và không thể kiểm soát được, bằng các loại thuốc thích hợp hoặc chế độ ăn uống đặc biệt, bác sĩ sẽ làm gián đoạn điều trị MIRCERA của bạn hoặc giảm liều.
• Bác sĩ sẽ kiểm tra xem huyết sắc tố của bạn không vượt quá một mức nhất định, cao như vậy huyết sắc tố có thể khiến bạn có nguy cơ gặp vấn đề về tim hoặc mạch máu và có thể làm tăng nguy cơ huyết khối, bao gồm tắc mạch phổi, nhồi máu cơ tim, đột quỵ và cái chết.
• Liên hệ với bác sĩ nếu bạn cảm thấy mệt mỏi, yếu hoặc khó thở, vì điều này có thể có nghĩa là rằng điều trị MIRCERA của bạn không hiệu quả. Bác sĩ sẽ kiểm tra xem bạn không có nguyên nhân khác của thiếu máu và có thể thực hiện xét nghiệm máu hoặc kiểm tra tủy xương của bạn. nếu bạn đã phát triển PRCA, việc điều trị MIRCERA của bạn sẽ bị ngừng. Bạn sẽ không nhận được ESA khác và bác sĩ sẽ điều trị cho bạn về tình trạng này.
Trẻ em và thanh thiếu niên
Điều trị bằng MIRCERA không được khuyến cáo ở trẻ em và thanh thiếu niên, vì nó chưa được nghiên cứu ở những bệnh nhân này.
Chăm sóc đặc biệt với người bệnh đang sử dụng các sản phẩm khác kích thích sản xuất hồng cầu:
MIRCERA là một của một nhóm các sản phẩm kích thích sản xuất các tế bào hồng cầu như protein của con người erythropoietin nào. Chuyên gia chăm sóc sức khỏe của bạn sẽ luôn ghi lại chính xác sản phẩm bạn đang sử dụng.
Phản ứng da nghiêm trọng bao gồm hội chứng Stevens-Johnson (SJS) và hoại tử biểu bì độc hại (TEN) đã được báo cáo liên quan đến điều trị epoetin.
SJS / TEN ban đầu có thể xuất hiện dưới dạng các đốm giống như mục tiêu màu đỏ hoặc các mảng tròn thường có mụn nước. Ngoài ra, loét miệng, cổ họng, mũi, bộ phận sinh dục và mắt (mắt đỏ và sưng) có thể xảy ra.
Những phát ban da nghiêm trọng này thường xảy ra trước sốt và / hoặc các triệu chứng giống như cúm. Các phát ban có thể tiến triển đến bong tróc da và biến chứng đe dọa tính mạng. Nếu bạn bị phát ban nghiêm trọng hoặc các triệu chứng da khác, hãy ngừng dùng Mircera và liên hệ với bác sĩ hoặc tìm kiếm sự chăm sóc y tế ngay lập tức.
Mang thai, cho con bú và khả năng sinh sản
Hãy hỏi bác sĩ hoặc dược sĩ của bạn để được tư vấn trước khi dùng bất kỳ loại thuốc nào. MIRCERA chưa được nghiên cứu ở phụ nữ mang thai hoặc cho con bú.
Hãy cho bác sĩ của bạn nếu bạn đang mang thai, nghĩ rằng bạn đang mang thai hoặc có ý định mang thai. Bác sĩ của bạn sẽ xem xét điều trị tốt nhất cho bạn trong thai kỳ là gì.
Hãy cho bác sĩ của bạn biết nếu bạn đang cho con bú hoặc có ý định cho con bú. Bác sĩ sẽ tư vấn nếu bạn nên dừng hoặc tiếp tục cho con bú và ngừng hoặc tiếp tục điều trị của bạn.
MIRCERA đã không cho thấy bằng chứng về khả năng sinh sản bị suy giảm ở động vật. Nguy cơ tiềm ẩn cho con người là không xác định.
Lái xe và sử dụng máy móc
MIRCERA không ảnh hưởng đến khả năng lái xe và sử dụng máy của bạn.
Tương tác thuốc
Các loại thuốc khác và MIRCERA
Hãy cho bác sĩ hoặc dược sĩ của bạn nếu bạn đang sử dụng, gần đây đã sử dụng hoặc có thể sử dụng bất kỳ loại thuốc nào khác.
Không có nghiên cứu tương tác đã được thực hiện. Không có bằng chứng cho thấy MIRCERA tương tác với thuốc men.
MIRCERA với thức ăn và đồ uống
Thực phẩm và đồ uống không ảnh hưởng đến MIRCERA.
Tác dụng không mong muốn
Một tác dụng phụ phổ biến (có thể ảnh hưởng đến 1 trên 10 người)
Tăng huyết áp (huyết áp cao).
Tác dụng phụ không phổ biến (có thể ảnh hưởng đến 1 trên 100 người) là:
• đau đầu
• huyết khối trong mạch máu (cục máu đông trong lọc máu ).
• Giảm tiểu cầu
Tác dụng phụ hiếm gặp (có thể ảnh hưởng đến 1 trên 1000 người) là:
• Bệnh não tăng huyết áp (huyết áp rất cao có thể dẫn đến đau đầu, đặc biệt là Đột ngột đau đầu giống như đau nửa đầu, nhầm lẫn, rối loạn ngôn ngữ, phù hợp hoặc co giật).
• Thuyên tắc phổi.
• nổi mẩn đỏ ở da (phản ứng da đỏ có thể nổi mụn hoặc đốm)
• nóng bừng
• mẫn cảm (phản ứng dị ứng có thể gây ra khò khè bất thường hoặc khó thở; sưng lưỡi, mặt hoặc cổ họng, hoặc sưng xung quanh vị trí tiêm, hoặc làm cho bạn cảm thấy lâng lâng, ngất xỉu hoặc khiến bạn suy sụp).
Nếu bạn có những triệu chứng này, vui lòng liên hệ với bác sĩ của bạn ngay lập tức để được điều trị.
Trong các nghiên cứu lâm sàng, bệnh nhân bị giảm nhẹ lượng máu tiểu cầu. Đã có báo cáo về số lượng tiểu cầu dưới mức bình thường (giảm tiểu cầu) trong cài đặt sau khi sản phẩm ra thị trường.
Phản ứng quá mẫn, bao gồm cả các trường hợp phản ứng phản vệ và phát ban da nghiêm trọng bao gồm Hội chứng Stevens-Johnson (SJS) và hoại tử biểu bì độc hại đã được báo cáo trong hiệp hội với điều trị epoetin. Chúng có thể xuất hiện dưới dạng các hạt giống như mục tiêu màu đỏ hoặc các bản vá tròn thường với mụn nước , bong tróc da, loét miệng, cổ họng, mũi, bộ phận sinh dục và mắt và có thể đi trước sốt và các triệu chứng giống cúm.
Ngừng sử dụng Mircera nếu bạn phát triển các triệu chứng này và liên hệ với bác sĩ của bạn hoặc tìm kiếm sự chăm sóc y tế ngay lập tức.
Cũng như các ESA khác, các trường hợp huyết khối, bao gồm thuyên tắc phổi, đã được báo cáo trong thiết lập hậu tiếp thị.
Một tình trạng gọi là bất sản tế bào hồng cầu nguyên chất (PRCA, ngừng hoặc giảm sản xuất hồng cầu) do kháng thể kháng erythropoietin đã được quan sát thấy ở một số bệnh nhân được điều trị bằng ESA, bao gồm MIRCERA.
Quá liều
Nếu bạn sử dụng MIRCERA nhiều hơn bạn nên
Vui lòng liên hệ với bác sĩ hoặc dược sĩ của bạn nếu bạn đã sử dụng liều MIRCERA quá lớn vì có thể cần thiết để thực hiện một số xét nghiệm máu và làm gián đoạn điều trị của bạn.
Bảo quản
Lưu trữ trong tủ lạnh (2 ° C – 8 ° C).
Không đóng băng.
Giữ ống tiêm trong thùng carton để tránh ánh sáng.