Xi măng sinh học được cấu tạo từ chất polymethylmetacrylate (PMMA) được ứng dụng rộng rãi trong lĩnh vực phẫu thuật tạo hình xương, khớp. Cũng giống như tất cả các loại vật liệu sinh học khác PMMA làm tăng nguy cơ nhiễm khuẩn cao hơn so với việc sử dụng các mô sinh học. Chính vì thế, một câu hỏi hiện ra là việc sử dụng PMMA trong phẫu thuật tạo hình xương, khớp kết hợp với thuốc kháng sinh có làm giảm nguy cơ nhiễm khuẩn hay không đã được đem ra bàn luận.
Mặc dù quá trình phẫu thuật luôn được bảo đảm khử trùng nghiêm ngặt và khép kín, sử dụng dòng chảy tầng với tỉ lệ nhiễm khuẩn chỉ từ 1-3%. Buchholz và Engelbrecht là những người đầu tiên đề xuất sử dụng thuốc kháng sinh để ngăn nhiễm khuẩn sau khi phẫu thuật. Báo cáo đầu tiên về kết quả của việc sử dụng kháng sinh bởi Thierse cho rằng việc sử dụng thuốc kháng sinh sau khi phẫu thuật giúp giảm nguy cơ nhiễm khuẩn cao hơn so với việc không sử dụng thuốc kháng sinh sau khi phẫu thuật. Wannske và Tscherne cũng ủng hộ ý kiến này sau một nghiên cứu đoàn hệ. Nghiên cứu của Josefsson và Espehaug cùng với các cộng sự của mình đã đi đến 2 kết luận trái chiều. Tuy nhiên, việc sử dụng thuốc kháng sinh sau khi phẫu thuật vẫn được áp dụng rộng rãi cho đến ngày nay. Hiệu quả kháng khuẩn của bạc vốn được biết đến nhiều và được áp dụng trong lĩnh vực y học trong nhiều năm qua, ví dụ như phương pháp Crede trong phòng bệnh viêm kết mạc ở trẻ sơ sinh hay giúp làm lành vết thương. Mặt khác độc tính của bạc cũng được chỉ ra trong nhiều nghiên cứu lâm sàng. Mục đích chính của nghiên cứu này là đánh giá về phương pháp tạo hình xương, khớp bằng hạt xi măng nano bạc có chứa các phân tử bạc với kích cỡ chỉ từ 5-50nm. Phương pháp này cho thấy nano bạc có tác dụng chống lại vi khuẩn S. epidermidis, MRSE và MRSA qua các thí nghiệm ống nghiệm. Hơn nữa, độc tính của hạt nano bạc còn được đánh giá qua cả phương pháp nghiên cứu định lượng và nghiên cứu định tính
2. Phương pháp nghiên cứu
2.1. Hạt nano bạc
Thuật ngữ “nano bạc” ám chỉ kích thước của các phân tử bạc rất nhỏ, chỉ từ 5-50 nm (Ảnh 1). Hoạt động bề mặt của hạt nano bạc chỉ từ 4m2/g so với 1-2m2 của bạc bột bán ngoài thị trường. Các cụm hạt nano bạc thường có kích thước là 2-5 mm. Độ rỗng của hạt nano bạc từ 85-95% so với 0% của bạc bột bán ngoài thị trường.
2.2. Hạt xi măng
Hạt xi măng hay polymethylmetacrylate (PMMA) có chứa từ 0,1-1,0% nano bạc. Tỷ trọng hạt nano bạc được cân đối với tỷ trọng hạt xi măng. Hạt xi măng (PMMA) tinh chất (VersaBond, Smith & Nephew, Memphis, TN, USA) không có chứa bất cứ tạp chất nào hoặc chỉ chứa 2% gentamicin sulphate (PalacossR Gentamicin, ScheringPlough, Brussels, Belgium). Tất cả các loại hạt xi măng đều được trộn trong chân không (Easys, Coripharm, Dieburg, Germany). Sau đó, hỗn hợp xi măng này được đổ vào các khuôn có đường kính 4mm và chiều cao 7 mm.
2.3. Vi khuẩn
Phương pháp phân lập lâm sàng được sử dụng như một chỉ số đánh giá các chủng vi khuẩn khác nhau để kiểm soát các đặc tính kháng khuẩn trong ống nghiệm của các loại hạt xi măng (S. epidermidis EDCC 5245, methicillin-resistant S. epidermidis (MRSE) EDCC 5130 và methicillin-resistant S. aureus (MRSA) EDCC 5246 từ Viện Vi sinh vật, Giessen, Đức). Các chủng vi khuẩn được đánh giá phân tích trình tự gen mã hóa 16S rRNA, cụ thể là PCR gene femB, coa und mecA, mã DNA bằng phương pháp PFGE và kháng sinh đồ (không có dữ liệu). Nồng độ ức chế tối thiểu (MIC) của gentamicin đối với nhiều chủng vi khuẩn được xác định bằng E- Test (AB BIODISK, Solna, Sweden). S. epidermidis cần nồng độ ức chế tối thiểu o0.0064 mg/ml đối với gentamicin, MRSE EDCC 5130 64 mg/ml và MRSA EDCC 5246 64 mg/ml lần lượt.
2.4. Hoạt động của màng sinh học
MRSA EDCC 5246 hình thành màng sinh học, mặt khác S. epidermidis EDCC 5245 và MRSE EDCC 5130 thì không. Các thí nghiệm kiểm tra sự hình thành màng sinh học dựa trên khả năng tạo ra màng sinh học trên nhựa polystyren (PS) của từng loại vi khuẩn, ví dụ, sự phát triển của vi khuẩn lạc được phát hiện với một số lượng lớn. Các thí nghiệm về khả năng hình thành màng sinh học cũng đã được tiến hành nhiều trước đó. Nhìn chung quy trình này như sau, nuôi cấy vi khuẩn qua đêm trong canh trường được pha loãng tỉ lệ 1:100 đặt trong môi trường nuôi cấy và 200 ml chất nuôi cấy sạch để ở 37oC trong vòng 48 giờ. Phần nước nuôi cấy được bỏ đi, đĩa thí nghiệm được rửa kỹ càng 2 lần bằng dung dịch xử lý màng sinh học (2mm CaCl2/MgCl2) để loại bỏ hoàn toàn các tế bào trôi nổi. Tiếp theo, sử dụng 200 microlit dung dịch xử lý màng sinh học và 20 ml thuốc nhuộm (0,1% w/v dung dịch tím tinh thể) để làm nổi bật màng sinh học, sau đó để trong vòng 15 phút ở nhiệt độ phòng và được tráng lại bằng dung dịch xử lý màng sinh học để loại bỏ các phân tử tím tinh thể bám lại. Vi khuẩn có thể tạo ra màng sinh học ở mặt trong của đĩa thí nghiệm. Bên cạnh đó, các vi khuẩn lạc cũng có thể được thấy nhờ vào màu tím của thuốc.
2.5. Hoạt động kháng khuẩn trong ống nghiệm
Thí nghiệm hoạt động kháng khuẩn của các hạt xi măng khác nhau được tiến hành bằng cách sử dụng một máy lắc đĩa để đo sự sinh trưởng của vi khuẩn. Các mẫu thu được có hình trụ với chiều dài 7 mm và đường kính 4 mm ở các hạt xi măng khác nhau. Các mẫu hạt xi măng được ủ trong 106 CFU/giếng trong 250 ml huyền phù tế bào ở 37oC trong vòng 1 giờ. Các tế bào bong ra sẽ được loại bỏ bằng PBS. Sau khi làm sạch mẫu các tế bào còn sót lại sẽ được nuôi trong PBS 0,25% glucose, 0,2% (NH4)2SO4 và 1% canh trường để trong vòng 18 giờ ở nhiệt độ 37oC. Trong khoảng thời gian này, các tế bào còn lại sẽ bắt đầu phân chia và tạo ra nhiều tế bào khác hoặc bị chết. Sau khi loại bỏ mẫu tế bào mẹ, các tế bào mới sẽ được kích thích bằng cách bổ sung 50ml canh trường. Sự phát triển của các tế bào mới sẽ được quan sát ở mức 578 nm qua một phần mềm đọc. Máy đọc đĩa (VersaMaxs, thiết bị sinh học phân tử, Sunnyvale, California, Mỹ) được sử dụng để theo dõi được đặt ở chế độ động học để phát hiện sự phát triển của các tế bào mới trong 36 giờ và đồng thời cung cấp một đường tăng trưởng ở kết quả cuối cùng sau mỗi đợt. Nếu vi khuẩn bị ức chế hoàn toàn hoặc một phần do bề mặt của mẫu hạt xi măng, chúng hoàn toàn hoặc gần như không thể tạo ra các tế bào con (Ảnh 2). Tất cả các phương pháp đo được tiến hành gấp 6 lần (A-F). Trong chứng nội hoạt động kháng khuẩn vải nylon tráng bạc 99% (ShieldexTrading GmbH, Bremen, Đức) đã được sử dụng làm mẫu chứng dương. Một loại nylon tương tự không tráng bạc được sử dụng làm mẫu chứng âm. Nano bạc và các mẫu dò được phủ quanh bởi các thành phần trong máu trong một thí nghiệm để quan sát phản ứng kháng khuẩn của bề mặt hạt xi măng so với một thí nghiệm khác mẫu dò không được phủ các thành phần trên.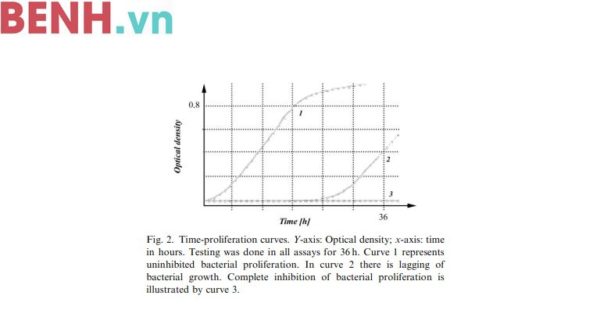
Theo mục đích ban đầu, các mẫu thử đều được nhúng vào huyết tương trong vòng 30 phút ở nhiệt độ 37oC trước khi tiến hành đo.
2.6. Kiểm tra độc tính trong ống nghiệm
Hạt xi măng nano bạc với tỷ trọng 1,0% bạc đã được tiến hành thí nghiệm trong lần này. 2 loại độc tính khác nhau đã được phát hiện. Đầu tiên, lọc rửa các hạt xi măng được thí nghiệm với nguyên bào sợi từ mô chuột. Tiếp theo, thí nghiệm nguyên bào xương người trên hạt xi măng.
2.6.1. Lọc rửa – độc tính định lượng
3 tiêu chí đã đo được: (1) sự giải phóng lactate dehydrogenase, (2) số lượng các tế bào gốc, (3) hàm lượng protein trong nguyên bào sợi mô chuột.
2.6.1.1. Sự giải phóng của lactate dehydrogenase
Hạt xi măng (đường kính: 36mm, bề dày: 3mm) được nuôi trong môi trường DMEM ở 37oC và 5% pCO2 trong vòng 48 giờ. Tỉ lệ diện tích/thể tích của hạt xi măng và môi trường nuôi cấy là 2cm2/ml. Chất hoạt động bề mặt Triton X-100 và dung dịch nuôi cấy tế bào không độc được dùng như mẫu chứng. Sau khi thí nghiệm kết thúc, dung dịch nuôi cấy được gạn lọc và bổ sung thêm huyết thanh thai bê (tỷ lệ FCS trong dung dịch nuôi cấy tế bào là 10%). Dung dịch nuôi cấy tế bào chứa FCS được nhỏ vào nguyên bào sợi từ của chuột trong 24 well plates (50,000 tế bào mỗi well) trước khi nuôi cấy, sau đó các tế bào này được nuôi ở nhiệt độ 37oC và 5% pCO2 trong vòng 48 giờ. Sự giải phóng ra lactate dehydrogenase được đo bằng công nghệ enzyme với độ hấp thu ở mức 450 nm.
2.6.1.2. Tổng hàm lượng protein
Sau đó, các tế bào được dung giải bằng cách thêm 20% NaOH và nuôi cấy trong vòng 1 giờ ở 75oC, tổng tỷ lệ protein ở các tế bào bị dung giải được đánh giá bằng phương pháp Bradford. Thí nghiệm được tiến hành chỉ với hạt xi măng để ngăn sự tương tác trực tiếp giữa các mẫu thử.
2.6.1.3. Số lượng tế bào gốc
Trong một đĩa cấy tế bào 24 giếng, nguyên bào sợi L929 được cố định bằng methanol và được làm sạch bằng PBS, tạo màu bằng dung dịch màu xanh methylene có chứa methylene blue, ethanol và HCL. Có thể loại bỏ đi màu sắc bằng cách rửa cùng dung dịch alkaline borate buffer. Sau khi loại bỏ đi màu xanh bằng axit ethanol, số lượng tế bào được xác định qua mật độ quang học ở mức 590 nm. Trước khi cố định số tế bào chính xác, thể nổi sẽ được loại bỏ bằng một hệ thống hút.
2.6.2. Sự tăng trưởng của nguyên bào xương người – độc tính định tính
Đĩa chứa hạt xi măng được thêm vào 2 ml nguyên bào xương người hFOB 1.19 với nồng độ 200,000 tế bào/ml để trong 48 giờ ở 37oC và 5% pCO2 trong môi trường DMEM (+10% FCS). Môi trường nuôi cấy tế bào (DMEM + 10% FCS) không độc với Triton X-100 là mẫu chứng độc. Sau khi nuôi cấy mẫu thử được rửa lại 2 lần bằng dung dịch đệm PBS. CalceinAM và ethidium-dimer được sử dụng để tạo màu cho các nguyên bào xương sống và các nguyên bào xương chết.
3. Kết quả
3.1. Hoạt động kháng khuẩn trong ống nghiệm
3.1.1. S. epidermidis EDCC 5245 (Ảnh 3)
Hạt xi măng PMMA tinh chất không thể ức chế sự tăng sinh của S. epidermidis EDCC 5245, trái lại hạt xi măng kháng sinh thường dẫn tới sự ức chế tăng sinh hoàn toàn của các loại vi khuẩn. Hàm lượng nano bạc trong hạt xi măng càng cao, hiệu quả kháng khuẩn càng cao. Hạt xi măng với hàm lượng 1% nano bạc hoàn toàn ức chế được sự sinh trưởng của S. epidermidis EDCC 5245 và cũng có hiệu quả tương tự như hạt xi măng kháng sinh.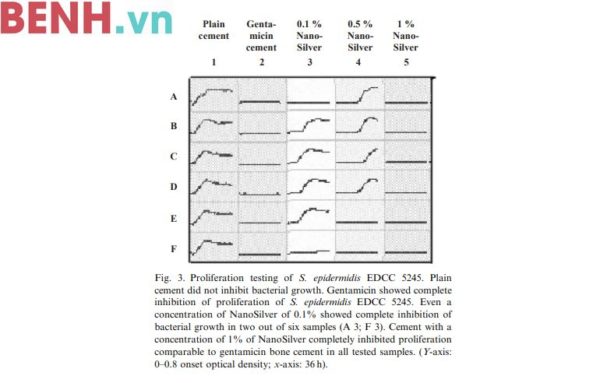
3.1.2. MRSE EDCC 5130 (Ảnh 4)
MRSE EDCC 5130 không khác biệt khi ở trong cả hạt xi măng tinh chất và hạt xi măng kháng sinh. Cả hạt xi măng tinh chất và hạt xi măng kháng sinh đều không có hiệu quả chống lại MRSE EDCC 5130. Hạt xi măng 1% nano bạc có hiệu quả chống lại MRSE EDCC 5130 cao hơn và có thể ức chế hoàn toàn được sự sinh trưởng của loại vi sinh vật này. Bên cạnh đó, hiệu quả của nano bạc cũng tùy thuộc vào liều lượng. Hạt xi măng với hàm lượng nano bạc 1% là loại hạt xi măng duy nhất có khả năng ức chế hoàn toàn được sự sinh trưởng của MRSE EDCC 5130.
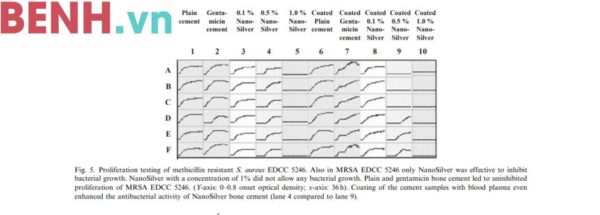
3.1.3. MRSA EDCC 5246 (Ảnh 5)
Quan sát tương tự đối với MRSE EDCC 5130 đã được thực hiện trên MRSA EDCC 5246. Hàm lượng nano bạc 1% có hiệu quả cao trong việc chống lại MRSA EDCC 5246. Tuy nhiên, hạt xi măng kháng sinh và hạt xi măng tinh chất không thể ức chế được sự sinh trưởng của MRSA EDCC 5246.
3.1.4. Phủ mẫu thử hạt xi măng bằng huyết tương (Ảnh 5)
Phủ hạt xi măng nano bạc bằng máu hoặc các thành phần của máu (Ảnh 5, cột 6-10) trong thí nghiệm trên MRSA EDCC 5246 không làm giảm hiệu quả kháng khuẩn so với hạt xi măng nano không phủ các thành phần trên với hàm lượng nano như nhau (Ảnh 5, cột 3-5). Mặt khác, hiệu quả kháng khuẩn của hạt xi măng nano có cao hơn một chút. Điều này không được thấy ở mẫu hạt xi măng kháng sinh.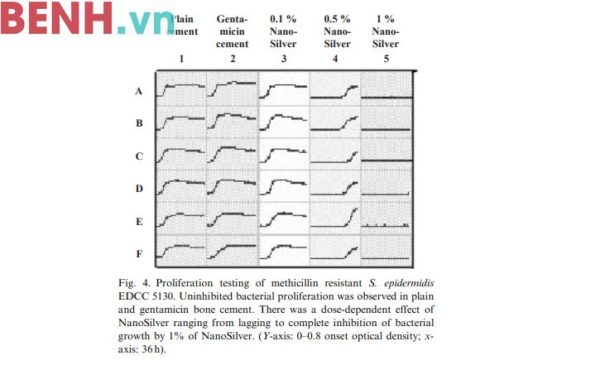
3.2. Độc tính trong thí nghiệm ống nghiệm
3.2.1. Xét nghiệm tách rửa – độc tính định tính
Giải phóng lactate dehydrogenase là thước đo cho tính toàn vẹn của tế bào. Sau 48 giờ, không có bất kỳ sự thay đổi đáng kể nào trong sự giải phóng lactate dehydrogenase giữa hạt xi măng bạc và chứng thử không độc. Trái lại, có một sự thay đổi đáng kể giữa hạt xi măng bạc và nhóm Triton (Ảnh 6). Tất cả các thí nghiệm về hàm lượng protein đều không phát hiện ra được thay đổi đáng kể nào giữa môi trường trích xuất hạt xi măng và môi trường nuôi cấy tế bào không độc. Giữa tổng hàm lượng protein được phân lập từ chứng thử độc và hạt xi măng bạc và giữa chứng thử độc và môi trường nuôi cấy tế bào có sự khác biệt lớn (Ảnh 6b). Nhiều nguyên bào sợi được cấy trong môi trường cấy tế bào không độc không khác biệt nhiều lắm so với những tế bào được cấy trong môi trường trích xuất hạt xi măng bạc. Nhóm chứng thử độc khác hẳn so với cả 2 nhóm còn lại (Ảnh 6c). Hạt xi măng nano bạc khi được phân tích dựa trên các xét nghiệm định lượng không có độc tính. Dữ liệu không chỉ ra bất kỳ sự khác biệt đáng kể nào so với nhóm chứng thử không độc.
3.2.2. Sự phát triển của nguyên bào xương người – độc tính định tính
Nguyên bào xương người phát triển theo kiểu mạng lưới trong môi trường nuôi cấy tế bào (Ảnh 7a). Hầu như tất cả các tế bào đều sống khi soi dưới kính hiển vi. Các tế bào này đều hình thành nên nhiều quá trình theo cụm tại tâm của môi trường nuôi cấy tế bào. Sau khi thêm Triton các tế bào bị tiêu diệt toàn bộ, không còn tế bào sống nào được thấy nữa. Các nguyên bào xương hình thành các quá trình tế bào trên hạt xi măng nano bạc ở nhóm chứng thử không độc cho thấy tính tương hợp của hạt xi măng. Chỉ một vài nguyên bào xương chết được phát hiện nhờ vào màu sắc ở hạt xi măng nano (Ảnh 7).
3.3. Tóm tắt kết quả
Hạt xi măng nano bạc là loại hạt xi măng duy nhất hoàn toàn ức chế được sự sinh trưởng của S. epidermidis EDCC 5245, MRSE EDCC 5130 và MRSA EDCC 5246. Hạt xi măng kháng sinh cũng có thể ức chế được sự sinh trưởng của S. epidermidis EDCC 5245 nhưng không có hiệu quả chống lại MRSE EDCC 5130 hay MRSA EDCC 5246. Hạt xi măng tinh chất PMMA không có hiệu quả kháng khuẩn với tất cả các chủng virus. Không có sự khác biệt lớn nào trong các xét nghiệm độc tính định tính hay độc tính định lượng giữa hạt xi măng nano bạc và nhóm chứng thử không độc. Chính vì vậy, hạt xi măng nano bạc không có bất cứ độc tính nào trong thí nghiệm ống nghiệm lần này.
4. Thảo luận
Các vật liệu sinh học có tính kháng khuẩn để kết hợp với hạt xi măng phải đáp ứng được một số điều kiện tiên quyết quan trọng. Đầu tiên, chúng phải hiệu quả trong việc giảm tỉ lệ nhiễm khuẩn trong phẫu thuật thay khớp toàn phần. Thứ hai, vật liệu sinh học không được gây ra những phản ứng độc quá mức trong cơ thể người. Hơn nữa, đối mặt với các vấn đề như nhiễm khuẩn đa kháng kháng sinh sau phẫu thuật đang tăng lên, hạt xi măng kháng khuẩn nên làm tốt nhiệm vụ để giảm tối đa nguy cơ vi khuẩn kháng kháng sinh.
Thảo luận dưới đây tập trung chủ yếu vào những vấn đề chính như thứ gì nên được kết hợp với hạt xi măng, kháng sinh hay bạc? Trong thập kỷ trước, số lượng và phần trăm các ca nhiễm trùng sâu tại vị trí phẫu thuật xương do vi khuẩn kháng kháng sinh tăng lên. Nhiễm các loại vi khuẩn đa kháng kháng sinh như S. aureus (MRSA) kháng methicillin hay S. epidermidis kháng methicillin (MRSE) gây ra những biến chứng nặng. Trong những trường hợp nhiễm những loại vi khuẩn kháng kháng sinh này ở vị trí thay hông hay đầu gối thường làm giảm tỉ lệ thành công của ca phẫu thuật giảm xuống đáng kể so với nhiễm những loại vi khuẩn không kháng kháng sinh. Qua đây thấy được tầm quan trọng của việc cảnh giác ngay từ đầu với không chỉ nguy cơ nhiễm trùng nói chung mà còn với cả những loại vi khuẩn kháng kháng sinh.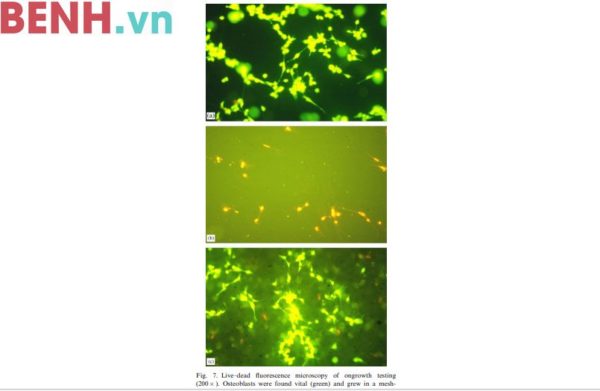
Những loại kháng sinh hay được sử dụng để kết hợp với hạt xi măng nhất là tobramycin hay gentamicin. Hạt xi măng trộn gentamicin không có độc tính được cho biết qua một nghiên cứu kéo dài 10 năm. Cả MRSE EDCC 5130 và MRSA EDCC 5245 trong nghiên cứu hiện tại đều kháng gentamicin ở mức cao (MIC 64 mg/ml). Điều này khiến cho hạt xi măng trộn gentamicin trở nên kém hiệu quả. S. epidermidis EDCC 5245 kháng gentamicin ở mức cực kỳ thấp (MIC of o0.0064 mg/ml), điều này giải thích cho tính tương hợp giữa S. epidermidis và hạt xi măng trộn gentamicin.
Sự kháng gentamicin không phải là một tình trạng do lạm dụng mà là một vấn đề nghiêm trọng hơn và đây cũng chính là điểm hạn chế lớn nhất của hạt xi măng trộn gentamicin. Hạt xi măng trộn gentamicin cũng làm tăng nguy cơ nhiễm những loại vi khuẩn kháng gentamicin cao hơn so với hạt xi măng tinh chất qua một thí nghiệm được tiến hành bởi Thornes và các cộng sự. Ông và các cộng sự cũng chỉ ra rằng bề mặt hạt xi măng đã được trộn kháng sinh là môi trường lý tưởng cho sự phát triển của các chủng vi khuẩn kháng kháng sinh do thời gian tiếp xúc với kháng sinh kéo dài đủ để thích nghi. Nghiên cứu cũng chỉ ra rằng sử dụng PMMA khiến cho sự phát triển của các khuẩn lạc nhỏ của chủng Staphylococcus kháng kháng sinh gây nhiễm khuẩn kéo dài sau khi phẫu thuật.
Chính vì vậy, hạt xi măng trộn gentamicin có thể được xem như có hiệu quả kháng khuẩn tương đối và độc tính thấp (Ảnh 8). Trong lúc này, một loại thuốc kháng khuẩn mới ra đời là điều đang rất được mong chờ. Bên cạnh hiệu quả kháng khuẩn của kháng sinh, bạc cũng là một chất có khả năng kháng khuẩn tốt. Dueland và các cộng sự đã đánh giá tác dụng của hạt xi măng trộn bạc sulphate trên thỏ. S. aureus đã được tiêm vào ống tủy xương chày của thỏ trong khi phẫu thuật. Những con thỏ được này có tỉ lệ sống thấp hơn hẳn những con thỏ được tiến hành bằng hạt xi măng bạc sulphate.
Tính kháng khuẩn cao cũng đồng thời làm suy giảm chức năng của hệ thần kinh ngoại biên. Điều này được nhận thấy qua những nghiên cứu về biến chứng nhiễm độc thần kinh ở một bệnh nhân được điều trị bằng hạt xi măng trộn bạc.
Hàm lượng ion bạc tăng lên cực kỳ cao trong huyết tương và hoạt dịch khớp hông khiến cho quá trình nhiễm độc bạc diễn ra sau 5 năm sau khi cấy ghép. Không có bất cứ yêu cầu cụ thể nào cho loại bạc được kết hợp với hạt xi măng. Do hàm lượng ion bạc cao nên việc sử dụng muối bạc là hoàn toàn có khả năng.
Ảnh hưởng độc tố có thể cản trở việc sử dụng loại xi măng bạc này liên tục cả ngày mặc dù có tính kháng khuẩn tốt (Ảnh 8). Mặc dù không có bất kỳ tác dụng phụ nào do độc tố trong các thí nghiệm ống nghiệm của hạt xi măng trộn phân tử bạc. Nhưng vẫn cần thêm thời gian để đánh giá các thử nghiệm ống nghiệm, đặc biệt là sau thử nghiệm ngăn viêm màng trong tim bằng van nhân tạo (AVERT). Van tim được phủ một lớp bạc (Silzones, St. Jude Medical, Minneapolis, MN, USA) đã được loại bỏ độc tính trong một thí nghiệm về tính tương hợp của nguyên bào sợi và tính tương hợp sinh học trong một mô hình sinh trưởng bên trong của cừu.
Dựa trên những dữ liệu này và hiệu quả kháng khuẩn đầy triển vọng của hạt xi măng được phủ bạc, một thử nghiệm lâm sàng trên 4400 bệnh nhân đã được tiến hành năm 1998. Trong năm 2002, 2 nhóm thử nghiệm được báo lại có tỉ lệ hở cận van tim tăng ở bệnh nhân có van Silzones, điều này góp phần gây ra sự nhạy cảm quá mức hay dị ứng và ức chế sự phát triển của nguyên bào sợi bình thường dẫn đến việc phải tháo van Silzone. Có một số sự khác biệt lớn giữa van Silzone và hạt xi măng nano bạc.
Đầu tiên là phân tử nano bạc hoạt động bề mặt rộng hơn và phân bổ đồng đều hơn so với phân tử bạc trên bề mặt van Silzone. Tiếp theo là bề mặt van Silzone được phủ một lớp bạc, lớp bạc này có nguy cơ bị bong ra ở môi trường áp suất cao, trái lại nano bạc được thêm vào hạt xi măng sau đó trộn lại. Về lâu dài, những nghiên cứu trong ống nghiệm sẽ chỉ ra rõ hơn về những ảnh hưởng do độc tính của nano bạc trong hạt xi măng. Bằng cách kết hợp những cấu trúc tế bào lại với nhau như enzyme với các protein, đặc biệt là nhóm SH, các ion bạc can thiệp vào tính toàn vẹn của tế bào vi khuẩn và quá trình tạo ra năng lượng của chúng. Chế độ kháng khuẩn nhiều mức độ này bảo đảm rằng sự đề kháng không dễ dàng xảy ra chỉ bởi một đột biến điểm, trái với kháng sinh nhóm aminoglycoside sự đề kháng có thể xảy ra dễ dàng hơn nhiều. Kháng bạc đã từng nhắc tới, nhưng cho tới nay nó không ảnh hưởng quá nhiều tới hệ vi sinh vật trong cơ thể. Câu hỏi thường được đặt ra là tại sao bạc không có những ảnh hưởng độc tính lên các tế bào nhân thực. Các tế bào nhân thực thường lớn hơn các tế bào nhân sơ và thường là mục tiêu lớn hơn nhiều cho việc tấn công các ion bạc.
Các tế bào nhân thực cũng có cũng có cấu trúc và chức năng ở mức cao hơn so với các tế bào nhân sơ. Chính vì vậy, phải cần tới một hàm lượng ion bạc đủ cao để có thể thấy được những ảnh hưởng độc tính so với các tế bào vi khuẩn. Sự khác biệt này mang tới một “cửa sổ điều trị”, các tế bào vi khuẩn có thể bị tiêu diệt thành công, trái lại những tác động có hại lên các tế bào nhân thực không còn nữa. Phản ứng của bạc lên sự tạo ra năng lượng tế bào có thể được coi là một ví dụ minh họa.
Các phức hợp protein của chuỗi truyền điện tử được đặt trên bề mặt tế bào, chính vì thế dễ dàng bị vô hiệu hóa bởi các ion bạc phản ứng. Ở các tế bào nhân thực có cấu trúc tương tự được phát hiện ở ty thể. Cần hàm lượng ion bạc lớn để vô hiệu hóa các protein ty thể do lớp niêm mạc tế bào hoạt động như một lớp hàng rào bảo vệ cần phải vượt qua đầu tiên. Hơn nữa, các tế bào nhân thực cũng có chứa một vài ty thể, trong khi các tế bào vi khuẩn thì không để có thể tự bảo vệ hệ thống bảo toàn năng lượng khỏi sự tấn công của các ion bạc. Vì thế, quá trình hô hấp của vi khuẩn bị cản trở nghiêm trọng, trong khi đó quá trình hô hấp tế bào không bị ảnh hưởng bằng. Hạt xi măng có chứa 1% nano bạc có khả năng kháng khuẩn cao và chống lại được hầu hết các chủng như MRSA EDCC 5246 hay MRSE EDCC 5130.
Phủ bề mặt hạt nano bạc bằng huyết tương được thực hiện để phỏng theo các biểu hiện lâm sàng sau khi phẫu thuật thay khớp toàn phần, hạt xi măng lúc này sẽ được phủ ngay lập tức với một lớp huyết tương trước khi tiêm vào xương. Lớp bọc huyết tương thậm chí cũng làm tăng hiệu quả kháng khuẩn của nano bạc và điều này cũng được chứng minh là phù hợp với mục đích lâm sàng. Hiệu quả kháng khuẩn tăng lên của bạc nhờ vào lớp phủ huyết tương cũng được báo lại sớm hơn so với những yếu tố khác. Bằng chứng khoa học cho điều này hiện không còn. Nhìn chung, nano bạc được chứng minh có tính kháng khuẩn tốt mà không có độc tính (Ảnh 8).
5. Kết luận
Hạt xi măng nano bạc hoàn toàn ức chế được sự sinh trưởng của S. epidermidis EDCC 5245, MRSE EDCC 5130 và MRSA EDCC 5246 mà không có độc tính qua thí nghiệm ống nghiệm. Nếu những kết quả này được xác định chắc chắn hơn qua các thí nghiệm trên vật thể sống, nano bạc có thể trở thành loại vật liệu sinh học được sử dụng nhiều nhất trong lĩnh vực phẫu thuật tạo hình xương, khớp, đặc biệt là nhờ vào đặc tính chống lại các loại vi khuẩn đa kháng kháng sinh, điều này không thể có được nhờ vào hạt xi măng kháng sinh. Những xét nghiệm độc tính trong ống nghiệm có sự cộng tác của bác sĩ Scheddin, CYTOX, 91052 Erlangen, Đức.
Tham khảo
[1] Breusch SJ, Aldinger PR, Thomsen M, Ewerbeck V, Lukoschek M. Anchoring principles in hip endoprostheses. I: prosthesis stem. Unfallchirurg 2000;103:918–31.
[2] Gristina AG. Biomaterial-centered infection; microbial adhesion versus tissue integration. Science 1987;237:1588–95.
[3] Buchholz HW, Engelbrecht H. Uber die Depotwirkung einiger . Antibiotika bei Vermischung mit dem Kunstharz Palacos. Chirurg 1970;40:511–5.
[4] Josefsson G, Gudmundsson G, Kolmert L, Wijkstrom S. Prophylaxis with systemic antibiotics versus gentamicin bone cement in total hip arthroplasty. A five-year survey of 1688 hips. Clin Orthop 1990;253:173–8.
[5] Thierse L. Erfahrungen mit Refobacin-Palacos im Hinblick auf die tiefen Spatinfektionen nach H . uftoperationen. Z Orthop . 1978;116:847–9.
[6] Wannske M, Tscherne H. Ergebnisse prophylaktischer Anwendung von Refobacin-Palacos bei der Implantation von Endoprothesen des Huftgelenkes in Hannover. In: Burri C, R . uter A, . editors. Lokalbehandlung chirurgischer Infektionen. Akt Probl Chir Ortho, vol. 12. Bern: Hans Huber; 1979. p. 201–8.
[7] Antti-Poika I, Josefsson G, Konttinen Y, Lidgren L, Santavirta S, Sanzen L. Hip arthroplasty infection. Current concepts. Acta Orthop Scand 1990;61:163–9.
[8] Harris WH, Sledge CB. The total hip and total knee replacement (Part II). N Engl J Med 1990;323:801–7.
[9] Josefsson G, Kolmert L. Prophylaxis with systemic antibiotics versus gentamicin bone cement in total hip arthroplasty. A tenyear survey of 1688 hips. Clin Orthop 1993;292:210–4. [10] Espehaug B, Engesaeter LB, Vollset SE, Havelin LI, Langeland N. Antibiotic prophylactics in total hip arthroplasty. J Bone Jt Surg Br 1997;79-B:590–5.
[11] van de Belt H, Neut D, Schenk W, van Horn JR, van der Mei HC, Busscher HJ. Infection of orthopedic implants and the use of antibiotic-loaded bone cements. A review. Acta Orthop Scand 2001;72:557–71.
[12] Kilgus DJ, Howe DJ, Strang A. Results of periprosthetic hip and knee infections caused by resistant bacteria. Clin Orthop 2002;404:116–24.
[13] Crede KSF. Die Verh ! utung der Augenentz . undung der Neugebor- . enen, der haufigsten und wuchtigsten Ursache der Blindheit. A. . Hirschwald, Berlin, 1894.
[14] Chu CS, McManus AT, Pruitt BA, Mason AD. Therapeutic effects of silver nylon dressing with weak direct current on Pseudomans aeruginosa infected burn wounds. J Trauma 1988; 28:1488–92.
[15] Deitch EA, Marin A, Malakanov V, Albright JA. Silver nylon cloth: in vivo and in vitro evaluation of antimicrobial activity. J Trauma 1987;27:301–4.
[16] Margraff HW, Covey TH. A trial of silver-zinc-allantoine in the treatment of leg ulcers. Arch Surg 1977;112:699–704.
[17] Wyatt D, McGowan DN, Najarian MP. Comparison of a hydrocolloid dressing and silver sulphadiazine cream in the outpatient management of second degree burns. J Trauma 1990; 30:857–65.
[18] Bechert T, Steinrucke P, Guggenbichler JP. A new method . for screening antibacterial biomaterials. Nat Med 2000;6: 1053–6.
[19] Bechert T, Boswald M, Lugauer S, Regenfus A, Greil J, . Guggenbichler JP. The Erlanger Silver Catheter: in vitro results for antimicrobial activity. Infection 1999;27(Suppl 1): S24–9. [20] Joyce-Wohrmann RM, M . unstedt H. Determination of silver ion . release from polyurethanes enriched with silver. Infection 1999; 27(Suppl. 1):S46.
[21] DiVincenzo GD, Giordano CJ, Schiever LS. Biologic monitoring of workers exposed to silver. Int Arch Occup Environ Health 1985;56:205–15.
[22] Franken E, Langhof H. Argyrosis universalis durch TargesinRollkulturen. Med Klein 1964;27:1094–6.
[23] Holzegel K. Uber die Agyrose der Haut und Schleimh . aute in der . chemischen Industrie. Z Ges Hyg 1970;16:440–7.
[24] Jensen EL, Rungby J, Hansen JC, Schmidt E, Pedersen B, Dahl R. Serum concentration and accumulation of silver in skin during three months treatment with an anti-smoking chewing gum containing silver accetate. Hum Toxicol 1988;7:535–40.
[25] Moss AP, Sugar A, Hargett NA, Atkin A, Wolkstein M, Roseman KD. The occular manifestations and functional effects of occupational argyrosis. Arch Ophthalmol 1979;97:90–908.
[26] Reinhardt G, Geldmacher V, Mallinckrodt M, Kittel H, Opitz O. Akute todliche Vergiftung mit Silbernitrat als Folge eines . Abtreibungsversuches. Arch Kriminol 1971;148:69–78.
[27] Konig O, Randerath O, Hackenbroch MH. Nosokomiale . Infektionen mit Methicillin-resistenten Staphylococcus aureus (MRSA)und -epidermidis (MRSE)Stammen: bedeutung, prophy- . laxe und therapie in der knochenchirurgie. Unfallchirurg 1999;102:324–8.
[28] Rosenman KD, Moss A, Kon S. Argyria: clinical implications of exposure of silver nitrate and silver oxide. J Occup Med 1979;21:430–5.
[29] Zech P, Colon S, Labeeuw R, Blanc-Brunat N, Richard P, Peron M. Syndrome nephrotique avec d ! epot d’argent. Nouv Presse M ! ed! 1973;2:161–4.
[30] O’Toole GA, Pratt LA, Watnick PI, Newman DK, Weaver VB, Kolter R. Genetic approaches to study of biofilms. Methods Enzymol 1999;310:91–109.
[31] Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem 1976;72:248–54.
[32] Hirikawa K, Stuhlberg BN, Wilde AH, Bauer TW. Secic M Results of 2-stage reimplantation for infected total knee arthroplasty. J Arthroplasty 1998;13:22–8.
[33] James PJ, Butcher IA, Gardner ER, et al. Methicillin-resistant Staphylococcus epidermidis in infection of hip arthroplasties. J Bone Jt Surg Br 1994;76-B:725–7.
[34] Hope PG, Kristinsson KG, Norman P, Elson RA. Deep infection of cemented total hip arthroplasty caused by coagulase-negative staphylococci. J Bone Jt Surg Br 1989;71-B:851–5. [35] Thornes B, Murray P, Bouchier-Hayes D. Development of resistant strains of Staphylococcus epidermidis on gentamicinloaded bone cement in vivo. J Bone Jt Surg Br 2002;84-B: 758–60.
[36] von Eiff C, Lindner N, Proctor RA, Winkelmann W, Peters G. Development of gentamicin-resistant small colony variants of S. aureus after implantation of gentamicin chains in osteomyelitis as a possible cause of recurrence. Z Orthop Ihre Grenzgeb 1998;136:268–71.
[37] Dueland R, Sparado JA, Rahn BA. Silver antibacterial bone cement. Clin Orthop 1982;169:264–8.
[38] Vik H, Andersen KJ, Julshamn K, Todnem K. Neuropathy caused by silver absorption from arthroplasty cement. Lancet 1985;13:872.
[39] Sudmann E, Vik H, Rait M, Todnem K, Andersen KJ, Julsham K, Flesland O, Rungby J. Systemic and local silver accumulation after total hip replacement using silver-impregnated bone cement. Med Prog Technol 1994;20:179–84.
[40] Tweden KS, Cameron JD, Razzouk AJ, Holmberg WR, Kelly SJ. Biocompatibility of silver-modified polyester for antimicrobial protection of prosthetic valves. J Heart Valve Dis 1997;6: 553–61.
[41] Butany J, Scully HE, VanArsdell G, Leask R. Prosthetic heart valves with silver-coated cuff fabric: early morphological features in two patients. Can J Cardiol 2002;18:733–8.
[42] Schaff HV, Carrel TP, Jamieson WRE, Jones KW, Rufilanches JJ, Cooley DA, Hetzer R, Stumpe F, Duveau D, Moseley P, van Boven WJ, Grunkemeier GL, Kennard ED, Holubkov R. Paravalvular leak and other events in silzone-coated mechanical heart valves: a report from AVERT. Ann Thorac Surg 2002;73:785–92.
[43] Ghandour W, Hubbard JA, Deistrung J, Hughes MN, Poole RK. The uptake of silver ions by Escherichia coli: toxic effects and interactions with copper ions. Appl Microbiol Biotechnol 1988;28:559–65.
[44] Grier N. Silver and its compounds. In: Block SS, editor. Disinfection, sterilization, and prevention. Philadelphia: Lea & Febiger; 1977. p. 395–407.
[45] Petering HG. Pharmacology and toxicology of heavy metals: silver. Pharmacol Ther A 1976;1:127–30.
[46] Schreurs WJ, Rosenberg H. Effect of silver ions on transport and retention of phosphate by Escherichia coli. J Bacteriol 1982;152: 7–13.
[47] Bragg PD, Rainnie DJ. The effect of silver ions on the respiratory chain of Escherichia coli. Can J Microbiol 1973;20: 883–9.
[48] Davies J, Wright GD. Bacterial resistance to aminoglycoside antibiotics. Trends Microbiol 1997;5:234–40. [49] Gupta A, Phung LT, Taylor DE, Silver S. Diversity of silver resistance genes in IncH incompatibility group plasmids. Microbiology 2001;147:3393–402.