Molnupiravir trên thực tế chưa phải một thuốc kháng virus được cấp phép đầy đủ mà đang được nghiên cứu lâm sàng Pha 3 trên các bệnh nhân mắc Covid-19 có xét nghiệm dương tính, có triệu chứng bệnh. Phát minh này thuộc sở hữu của hãng Merck, Hoa Kỳ. Hiện nay, Molnupiravir đang được triển khai tại Việt Nam để sử dụng cho một số bệnh nhân COVID-19 điều trị ngoại trú.
Mô tả thuốc kháng virus Molnupiravir
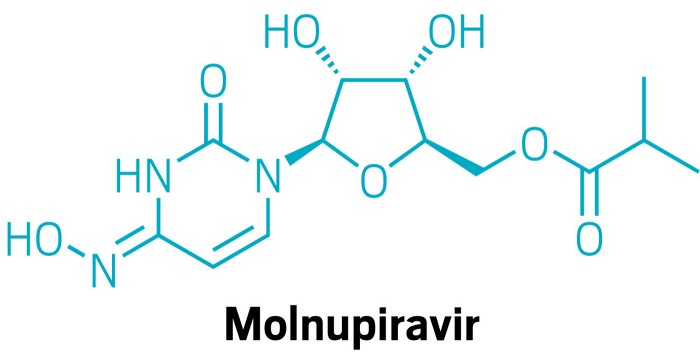
Molnupiravir (MK-4482, EIDD-2801) là một thuốc kháng virus dùng đường uống đang được thử nghiệm mà lần đầu tiên được phát triển để điều trị Cúm tại Đại học Emory, Hoa Kỳ. Molnupiravir bào chế dạng uống của một chất tương tự Ribonucleoside có khả năng ức chế mạnh RNA của nhiều loại virus, bao gồm SARS-CoV-2, tác nhân gây đại dịch COVID-19.
Chỉ định của Molnupiravir (MK-4482, EIDD-2801) kháng virus
Molnupiravir kháng virus được chỉ định để giảm thiểu nguy cơ nhiễm và lây truyền SARS-CoV-2, phòng ngừa mắc COVID-19.
Các nghiên cứu về Molnupiravir tới nay
Molnupiravir chứa chất tương tự Nucleoside N4-hydroxycytidine. Molnupiravir được chứng chống lại coronavirus (CoVs), boa gồm SARS-1, MERS-CoV. Thuốc cũng có hoạt tính trên một số mô hình SARS-CoV-2, bao gồm cả dự phòng, điều trị và ngăn ngừa lây nhiễm.
Hãng Merck đã tiến hành các chương trình phi lâm sàng toàn diện để mô tả đặc tính hồ sơ an toàn của Molnupiravir, bao gồm các thử nghiệm như Big Blue và PIG-a, được thiết kế để cung cấp phương pháp chắc chắn về khả năng một loại thuốc hay hóa chất có thể gây đột biến trên cơ thể sống. Thêm vào đó, những động vật được sử dụng Molnupiravir lâu hơn và liều cao hơn (mg/kg) so với các nghiên cứu trên người. Các nghiên cứu này chỉ ra rằng Molnupiravir không gây độc tế bào, không gây đột biến gen trên cơ thể động vật có vú.
Giai đoạn thử nghiệm Pha 3 trên toàn cầu có tên MOVe-OUT nghiên cứu Molnupiravir ở bệnh nhân ngoại trú với kết quả dương tính COVID-19 và có ít nhất một yếu tố nguy cơ có thể khiến bệnh nặng đang được tiến hành. Hơn nữa, Merck cũng có kế hoạch khởi động chương trình nghiên cứu lâm sàng để đáng giá hiệu quả của Molnupiravir cho dự phòng sau phơi nhiễm với SARS-CoV-2 ở nửa cuối năm 2021.
“Những dữ liệu này rất tiềm năng, và chúng tôi rất vui mừng được được trình bày các kết quả nghiên cứu pha 2 của Molnupiravir trong khi chúng tôi đang tiến hành với giai đoạn Pha 3 mang tên MOVe-OUT với bệnh nhân ngoại trú,” Wendey Holman, CEO, của Ridgeback Biotherapeutics, trong một bài phát biển vào 12 tháng 7 năm 2021. “Vẫn còn nhu cầu rất lớn về các giải pháp cho đại dịch, và chúng tôi rất hi vọng rằng Molnupiravir có thể đóng một vai trò trong giúp đỡ các bệnh nhân.”
Molnupiravir [USAN] RN: 2349386-89-4. UNII: YA84KI1VEW, InChIKey: HTNPEHXGEKVIHG-QCNRFFRDSA-N; PubChem CID145996610; CAS Number 2349386-89-4
Molnupiravir – Quá trình phát triển của thuốc
Molnupiravir xuất phát được nghiên cứu bởi công ty tiên phong về thuốc tại Đại học Emory ở Georgia là Drug Innovation Ventures at Emory. Sau đó, đơn vị này được mua lại bởi công ty Ridgeback Biotherapeutics, đối tác của Merck &Co. để tiếp tục phát triển thuốc kháng virus.
Lịch sử phát triển của Molnupiravir – hoạt chất kháng virus dùng trong Covid-19
Một nghiên cứu xuất bản vào 29 tháng 4 năm 2020, có thể về tiềm năng của Molnupiravir chống lại nhiều chủng Coronavirus (CoVs), và sinh khả dụng theo đường uống làm nổi bật tiềm năng sử dụng như một thuốc kháng virus hiệu quả chống lại SARS-CoV-2 và các chủng Coronavirus có thể có trong tương lai.
Vào 19 tháng 6 năm 2020, chi nhánh Ridgeback Biotherapeutics tại Miami thông báo khởi động nghiên cứu lâm sàng hai 2 Pha 2 để đánh giá hiệu quả của Molnupiravir như một loại thuốc kháng virus đề điều trị COVID-19. Nghiên cứu Pha 2a là thử nghiên lâm sàng mù đôi ngẫu nhiên có đối chứng của Molnupiravir với đàn ông và phụ nữ dương tính với SARS-CoV-2 trong 144 giờ với xét nghiệm khẳng định PCR và được nhập viện với chẩn đoán mắc COVID-19. Việc ghi danh và điều trị được bắt đầu nhanh chóng để đảm bảo liều điều tiên của Molnupiravir hoặc giả dược được sử dụng sớm nhất có thể trong vòng 7 ngày đầu tiên khởi phát triệu chứng.
Ngày 1 tháng 7 năm 2020, Merck và Ridgeback Biotherapeutics LP thông báo rằng Ủy ban thương mại Liên bang Hoa Kỳ đã cấp phép cho chấm dứt sớm thời gian chờ đợi theo đạo luật cải tiến chống độc quyền Hart-Scott-Rodino. Do đó, tất cả các yêu cầu kết thúc đã được hoàn thành cho giao dịch hợp tác được công bố trước đó nhằm thúc đẩy phát triển EIDD-2901, Molnupiravir, một tác nhân kháng virus nghiên cứu dùng đường uống đang được phát triển lâm sàng để điều trị cho bệnh nhân mắc COVID-19.
Ngày 25 tháng 1 năm 2021, Merck nói rằng Molnupiravir hiện tại đang được đánh giá trong thử nghiệm lâm sàng Phase 2/3 đối với bệnh nhân Nội trú và Ngoại trú. Ngày hoàn thành cơ bản các nghiên cứu Pha 2/3 là tháng 5 năm 2021. Công ty dự kiến dữ liệu hiệu quả ban đầu vào quý I năm 2021, Merck dự kiến sẽ chia sẻ công khai nếu có ý nghĩa về lâm sàng.
Vào ngày 6 tháng 3 năm 2021, Merck and Ridgeback Biotherapeutics tuyên bố các kết quả bước đầu từ nghiên cứu Phase 2a chứng minh an toàn, khả năng dung nạp và hiệu quả loại trừ RNA của virus SARS-CoV-2. Trong số 182 người tham gia với dịch mũi họng dương tính, có 42% (78/182) phát hiện virus ở mức cơ bản. Các công ty cũng đã báo cáo phát hiện về một mục tiêu thứ hai trong nghiên cứu Pha 2a, chứng minh khả năng giảm thời gian để âm tính virus trong dịch mũi họng từ người tham gia mắc COVID-19 có triệu chứng, xác định bằng phân lập nuôi cấy trong trong tế bào Vero. Vào ngày thứ 5, đã có sự giảm (p=0.001, không được kiểm soát về tính đa dạng) trong nuôi cấy virus dương tính ở nhóm dùng Molnupiravir (tất cả các liều) so với nhóm giả dược, cụ thể: 0% (0/47) ở nhóm Molnupiravir và 24% (6/25) ở nhóm giả dược.
Bác sỹ Wendy Painter, Giám đốc Y Khoa của Ridgeback Biotherapeutics, chia sẻ “Chúng tôi rất vui mừng chia sẻ dữ liệu lây nhiễm ban đầu của Phase 2 trong hội nghị quan trọng này, mặc dù vẫn chỉ là bước đầu trong những thông tin khoa học lâm sàng quan trọng trong bệnh truyền nhiễm.”
Bác sỹ Roy Baynes, người đứng đầu CMO phát triển lâm sàng toàn cẩu, Phòng thí nghiệm nghiên cứu Merck bổ sung “Chúng tôi tiếp tục đạt được các bước tiến trong các chương trình lâm sàng Phase 2/3 đánh giá Molnupiravir trên cả bệnh nhân ngoại trú và bệnh nhân nhập viện và dự kiến sẽ cập nhật thông tin khi thích hợp,”
Ngày 15 tháng 4 năm 2021, các công ty đã thông báo, “Dựa trên phân tích tamj thời theo kế hoạch những dữ liệu từ Pha 2, giai đoạn dò liều (Phần 1) của hai thử nghiệm có đối chứng tiếp tục đánh giá Molnupiravir dùng 2 lần mỗi ngày trong 5 ngày cho bệnh nhân ngoại trú (MOVe-OUT) và những bệnh nhân nhập viện (MOVe-IN) với COVID-19, và từ các nghiên cứu khoảng liều đã hoàn thiện ở Pha 2a với bệnh nhân ngoại trú, quyết định đã được đưa ra tiếp tục giai đoạn Pha 3 (Phần 2) của MOVe-OUT đối với bệnh nhân ngoại trú điều trị COVID-19, đánh giá liều dùng 800 mg Molnupiravir 2 lần mỗi ngày. Dữ liệu từ MOVe_IN chỉ ra rằng Molnupiravir có vẻ chứng minh không mang lại lợi ích lâm sàng với bệnh nhân nhập viện, những người thường đã xuất hiện triệu chứng dài hơn trước khi tham gia nghiên cứu; do đó, quyết định sẽ không tham gia Pha 3.
“Để phát triển một thuốc nhanh và trên quy mô toàn cầu ở tất cả các quốc gia khi cần thiết, bạn cần tới năng lực của một công ty như Merck,” George Painter, Giáo sư, CEO của tổ chức không lợi nhuận thuốc Emory, DRIVE. Ông cũng nói “Thật vui khi thấy họ phát triển nhanh như thế nào và làm thế nào họ đưa thuốc này tới cho người Ấn Độ để giải quyết mối nguy hại này.”
Wendy Holman, CEO của Ridgeback Biotherapeutics nói trong một báo cáo, “Chúng tôi rất vui vì Molnupiravir tiếp tục hứa hẹn trở thành một giải pháp điều trị tiềm năng cho những bệnh nhân COVID-19 ngoại trú. Dữ liệu từ nghiên cứu Ridgeback Bio’s EIDD-2801-2003 (MK-4482-006) kết hợp với nghiên cứu MK-4482-002 của Merck cung cấp các bằng chứng thuyết phục về khả năng kháng virus của Molnupiravir. Chúng ta nhìn về phía trước để hoàn thiện giai đoạn Pha 3 của nghiên cứu MOVe-OUT.”
Vào 9 tháng 6 năm 2021, Merck xác nhận trong một thông cáo báo chí rằng “công ty có kể hoạch để nộp hồ sơ xin phép sử dụng khẩn cấp hoặc phê duyệt cho các cơ quan quản lý bên ngoài Hoa Kỳ và hiện nay đang thảo luận với các quốc gia khác có quan tâm tới việc đồng ý đặc mua trước Molnupiravir. Merck cam kết cung cấp kịp thời Molnupiravir trên toàn cầu. Như một phần của chiến lược tiếp cận của mình, Merck cũng tham giả một thỏa thuận cấp phép tự nguyện không độc quyền đối với Molnupiravir với các nhà sản xuất thuốc gốc để đẩy nhanh việc sẵn có của Molnupiravir ở 104 quốc gia thu nhập thấp và trung bình sau khi được thông qua hoặc cho phép của các cơ quan quản lý.
Trụ sở Merck ở New Jersey (NYSE: MRK), được biết tới với tên MSD ở ngoài nước Mỹ và Canada, tập trung toàn bộ vào phát triển thuốc và vắc xin có nhiều bệnh thách thức hàng đầu thế giới cho việc theo đuổi sứ mệnh để bảo vệ và cải tiến sự sống.
Trụ sở của Ridgeback Biopharmaceuticals tại Florida được đồng sáng lập bởi CEO Wendy Holman và Bác sỹ Wayne Holman, một nhà tư vấn khoa học, tập trung vào phát triển các thuốc kháng virus cho dịch bệnh và đại dịch.
Thông tin về Molnupiravir kháng virus trên truyền thông
17 tháng 8 năm 2021, Trung tâm Phổi ở Philipin (LCP) và Trung tâm y tế tưởng niệm Quirino (QMMC) khuyến khích bệnh nhân COVID-19 tham gia thử nghiệm lâm sàng đánh giá hiệu quả kháng virus của Molnupiravir. Các bệnh viện cần tổng cộng 35 bệnh nhân. LCD đã tuyển được 15 bệnh nhân, và bệnh viện vẫn cần thêm 10 bệnh nhân nữa, trong khi QMMC cần 10 người tham gia.
13 tháng 8 năm 2021, Merck thông báo bắt đầu đệ trình luân phiên cho Bộ Y Tế Canada về Molnupiravir.
29 tháng 7 năm 2021 – Merck công bố tình hình tài chính trong quý II năm 2021.
12 tháng 7 năm 2021 – Merck và Ridgeback Biotherapeutics công bố kết quả nội bộ nghiên cứu Pha 2 từ Pha 2/3 thử nghiệm lâm sàng (MOVe-OUT và MOVe-IN) của Molnupiravir. Theo đó hãng sẽ tiếp tục thử nghiệm lâm sàng giai đoạn Pha 3 của nghiên cứu thử nghiệm MOVe-OUT trên bệnh nhân người lớn điều trị ngoại trú có xác nhận dương tính COVID-19 và có ít nhất 1 yếu tố nguy cơ khiến bệnh nặng. Merck cũng dự kiến sẽ khởi động một chương trình lâm sàng để đánh giá khả năng phòng bệnh sau phơi nhiễm vào nửa sau năm 2021. Cũng theo thông tin này, hãng ngưng không tiến hành nghiên cứu Pha 3 MOVe-IN với nhóm bệnh nhân COVID-19 điều trị tại viện do không thấy có bằng chứng chứng minh hiệu quả lâm sàng rõ rệt trên nhóm đối tượng này.
29 tháng 7 năm 2021 – Các công ty dược phẩm ở Ấn Độ thông báo họ sẽ cộng tác thử nghiệm lâm sàng Molnupiravir để điều trị COVID-19 nhẹ ở nhóm bệnh nhân ngoại trú. Các công ty này bao gồm Cipla Limited, Dr. Reddy’s Laboratories Ltd, Emcure Pharmaceuticals Limited, Sun Pharmaceutical Industries Limited, and Torrent Pharmaceuticals Limited.
9 tháng 6 năm 2021 – Merck thông báo thỏa thuận mua Molnupiravir với chính phủ Hoa Kỳ. Thông qua thỏa thuận, nếu Molnupiravir được chấp nhận cấp quyền sử dụng khẩn cấp hoặc được FDA Hoa Kỳ thông qua, Merck sẽ nhận được khoảng 1,2 tỷ đô la Mỹ để cung ứng 1.7 triệu liệu trình Molnupiravir cho chính phủ Hoa Kỳ. Merck đang mạo hiểm đầu tư để nâng công suất sản xuất của Molnupiravir và kỳ vọng có thể sản xuất 10 triệu liệu trình điều trị cho tới cuối năm 2021.
6 tháng 6 năm 2021 – Hoạt chất kháng virus Molnupiravir tham gia thử nghiệm lâm sàng pha 3 với COVID-19 tại Trung tâm phổi Philipin, theo chính quyền địa phương báo cáo. Nhóm đối tượng thử nghiệm là những người mắc COVID-19 có triệu chứng lâm sàng được xét nghiệm trong vòng 5 ngày trở lại, tuổi từ 18 trở lên và chưa được tiêm vắc xin.
25 tháng 5 năm 2021 – MSN Laboratories Pvt. Ltd. đã xác nhận rằng hãng đang khởi động thử nghiệm lâm sàng Pha 3 của viên nang Molnupiravir để điều trị COVID-19 ở Ấn Độ, với khoảng 2,400 người mắc COVID-19 từ nhẹ tới vừa.
25 tháng 5 năm 2021 – Optimus Pharma có trụ sở tại Hyderabad tuyên bố, “Optimus muốn bắt đầu ngay các thử nghiệm lâm sàng về Molnupiravir trên bệnh nhân COVID-19 ở Ấn Độ. Thử nghiệm lâm sàng sẽ cho chúng tôi biết hiệu quả của phân tử này trên bệnh nhân COVID-19,” Chủ tịch & Giám đốc điều hành, Tiến sỹ D Srinivas Reddy cho biết.
18 tháng 5 năm 2021 – Optimus Pharma thông báo họ đã nhận được sự chấp thuận của Cơ quan quản lý dược phẩm Ấn Độ để tiến hành các thử nghiệm lâm sàng phần cuối của Pha III cho Molnupiravir điều trị bệnh nhân COVID-19.
11 tháng 5 năm 2021 – Một bài báo trên tạp chí: Molnupiravir thúc đẩy gây đột biến SARS-CoV-2 thông qua khuôn mẫu RNA đã phát hiện ‘dữ liệu sinh hóa củng cố cơ chế hoạt động của Molnupiravir chủ yếu dựa trên sự gây đột biến RNA qua trung gian chuỗi mẫu.’
10 tháng 5 năm 2021 – Một phòng thí nghiệm virus học của Đại học Alberta đã phát hiện ra cách thức hoạt động của một chất kháng virus đường uống tấn công virus SARS-CoV-2, được công bố trên Tạp chí Sinh hóa. Các nhà nghiên cứu đã chứng minh cơ chế hoạt động cơ bản của Molnupiravir là thay đổi bộ gen của virus, một quá trình được gọi là đột biến quá mức hoặc “thảm họa lỗi”. Matthias Götte, giáo sư và chủ nhiệm Khoa Miễn dịch và Vi sinh y học thuộc Khoa y tế và Nha khoa, một thành viên của Viện virus học Lý Gia Thành, giải thích: “Polymerase, hay động cơ sao chép của virus, nhầm lẫn các phân tử Molnupiravir với các khối xây dựng tự nhiên cần cho sự nhân lên của bộ gen virus và kết hợp Molnupiravir lẫn vào”
27 tháng 4 năm 2021 – Merck thông báo công ty tham gia một thỏa thuận cấp phép tự nguyện không độc quyền đối với Molnupiravir với 5 công ty dược phẩm tại Ấn Độ. Merck tham gia thỏa thuận này để thúc đẩy nhanh việc sẵn có thuốc Molnupiravir ở Ấn Độ và các nước thu nhập thấp, trung bình sau khi có được sự chấp thuận và cho phép sử dụng khẩn cấp của các cơ quan quản lý sở tại.
27 tháng 4 năm 2021 – Bài báo của Đại học Emory: Thuốc kháng virus được phát minh bởi DRIVE của Emory được cấp phép sử dụng khẩn cấp COVID-19 tại Ấn Độ.
26 tháng 4 năm 2021 – Natco Pharma Limited có trụ sở tại Ấn Độ (NSE: NATCOPHARM; BSE: 524816) đã nộp đơn cho Tổ chức Kiểm soát Tiêu chuẩn Thuốc Trung ương (CDSCO) ở Ấn Độ để phê duyệt thử nghiệm lâm sàng Pha III của Viên nang Molnupiravir để điều trị COVID-19 ở bệnh nhân dương tính. NATCO hy vọng rằng CDSCO sẽ phê duyệt khẩn cấp loại thuốc này dựa trên “việc sử dụng nhân đạo” cho bệnh nhân. Công ty cho biết họ sẵn sàng ra mắt sản phẩm trong tháng này nếu được chấp thuận.
26 tháng 4 năm 2021 – Bài báo của BMJ: Chính phủ Anh đã thành lập Lực lượng đặc nhiệm chống virus để xác định các phương pháp điều trị được sử dụng tại nhà cho những người có kết quả xét nghiệm dương tính với SARS-CoV-2 để ngăn chặn virus lây lan và rút ngắn thời gian phục hồi. Cố vấn khoa học chính của chính phủ, Patrick Vallance, cho biết, “Thuốc chống virus ở dạng viên là một công cụ quan trọng khác để ứng phó. Thuốc có thể giúp bảo vệ những người không được bảo vệ hoặc không đủ điều kiện để tiêm vắc xin. Nó cũng có thể là một lớp phòng thủ khác khi đối mặt với các biến thể mới đáng lo ngại. Lực lượng đặc nhiệm sẽ giúp đảm bảo các loại thuốc kháng virus hứa hẹn nhất luôn sẵn sàng để triển khai càng nhanh càng tốt ”.
Nguồn: recisionvaccinations.com