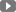Mục lục
Perjeta – Roche được sử dụng kết hợp trong liệt pháp điều trị ung thư vú sớm và ung thư vú di căn dành cho bệnh nhân trưởng thành.
Dạng trình bày
420 mg cô đặc cho dung dịch tiêm truyền
Dạng đăng kí
Thuốc kê đơn
Thành phần
Một lọ 14 ml cô đặc chứa 420 mg pertuzumab ở nồng độ 30 mg / ml.
Sau khi pha loãng, một ml dung dịch chứa khoảng 3,02 mg pertuzumab cho liều ban đầu và khoảng 1,59 mg pertuzumab cho liều duy trì
Pertuzumab là một kháng thể đơn dòng IgG1 được nhân hóa được sản xuất trong các tế bào động vật có vú (chuột đồng Trung Quốc) bằng công nghệ DNA tái tổ hợp.
Dược lực học
Cơ chế hoạt động
Pertuzumab là một kháng thể đơn dòng tái tổ hợp nhân tạo, đặc biệt nhắm mục tiêu vào miền làm giảm chất ngoại bào (miền phụ II) của protein thụ thể 2 yếu tố tăng trưởng biểu bì của con người, bao gồm cả HER HER3 và HER4. Kết quả là, pertuzumab ức chế tín hiệu nội bào bắt đầu từ ligand thông qua hai con đường tín hiệu chính là protein hoạt hóa mitogen (MAP) kinase và phosphoinositide 3-kinase (PI3K). Sự ức chế các con đường truyền tín hiệu này có thể dẫn đến việc ngừng tăng trưởng tế bào và apoptosis tương ứng. Ngoài ra, pertuzumab làm trung gian gây độc tế bào qua trung gian kháng thể (ADCC).
Trong khi pertuzumab đơn độc ức chế sự tăng sinh của các tế bào khối u ở người, sự kết hợp của pertuzumab và trastuzumab đã làm tăng đáng kể hoạt động chống ung thư trong các mô hình xenograft quá mức HER2.
Hiệu quả lâm sàng và an toàn
Hiệu quả của Perjeta trong ung thư vú dương tính với HER2 được hỗ trợ bởi thử nghiệm ngẫu nhiên giai đoạn III và thử nghiệm pha II một cánh tay trong ung thư vú di căn, hai thử nghiệm ngẫu nhiên giai đoạn II trong ung thư vú giai đoạn đầu (một đối chứng), không ngẫu nhiên thử nghiệm neoadju bổ sung giai đoạn II, và thử nghiệm ngẫu nhiên giai đoạn III trong cài đặt bổ trợ.
Sự biểu hiện quá mức HER2 được xác định tại một phòng thí nghiệm trung tâm và được xác định là điểm 3+ bởi IHC hoặc tỷ lệ khuếch đại ISH ≥2.0 trong các thử nghiệm .
Dược động học
Một phân tích dược động học dân số đã được thực hiện với dữ liệu từ 480 bệnh nhân qua các thử nghiệm lâm sàng khác nhau (giai đoạn I, II và III) với nhiều loại khối u ác tính tiên tiến đã nhận Perjeta như một tác nhân duy nhất hoặc kết hợp với liều pertuzumab từ 2 đến 25 mg / kg dùng mỗi 3 tuần dưới dạng tiêm truyền tĩnh mạch 30-60 phút.
Hấp thụ
Perjeta được dùng dưới dạng tiêm truyền tĩnh mạch.
Phân bố
Trên tất cả các nghiên cứu lâm sàng, thể tích phân bố của khoang trung tâm (Vc) và ngoại vi (Vp) ở bệnh nhân điển hình, lần lượt là 3,11 lít và 2,46 lít.
Biến đổi sinh học
Sự chuyển hóa của pertuzumab chưa được nghiên cứu trực tiếp. Kháng thể được loại bỏ chủ yếu bằng quá trình dị hóa.
Thải trừ
Độ thanh thải trung bình (CL) của pertuzumab là 0,235 lít / ngày và thời gian bán hủy trung bình là 18 ngày.
Tuyến tính / phi tuyến tính
Pertuzumab hiển thị dược động học tuyến tính trong phạm vi liều khuyến cáo.
Bệnh nhân cao tuổi
Dựa trên phân tích dược động học dân số, không thấy sự khác biệt đáng kể về dược động học của pertuzumab giữa bệnh nhân <65 tuổi (n = 306) và bệnh nhân ≥ 65 tuổi (n = 175).
Suy thận
Không có thử nghiệm suy thận chuyên dụng cho Perjeta đã được tiến hành. Dựa trên kết quả phân tích dược động học dân số, phơi nhiễm pertuzumab ở bệnh nhân nhẹ (độ thanh thải creatinin [CLcr] 60 đến 90 ml / phút, N = 200) và suy thận vừa (CLcr 30 đến 60 ml / phút, N = 71) tương tự như ở bệnh nhân có chức năng thận bình thường (CLcr lớn hơn 90 ml / phút, N = 200). Không có mối quan hệ giữa phơi nhiễm CLcr và pertuzumab được quan sát trong phạm vi CLcr (27 đến 244 ml / phút).
Các quần thể đặc biệt khác
Phân tích PK dân số cho thấy không có sự khác biệt PK dựa trên tuổi tác, giới tính và dân tộc (Nhật Bản so với không phải người Nhật Bản). Albumin cơ bản và trọng lượng cơ thể gầy là những đồng biến quan trọng nhất ảnh hưởng đến CL. CL giảm ở những bệnh nhân có nồng độ albumin cơ bản cao hơn và tăng ở những bệnh nhân có trọng lượng cơ thể gầy hơn. Tuy nhiên, các phân tích độ nhạy được thực hiện ở liều khuyến cáo và lịch trình của Perjeta cho thấy ở các giá trị cực trị của hai hiệp phương sai này, không có tác động đáng kể đến khả năng đạt được nồng độ trạng thái ổn định mục tiêu được xác định trong các mô hình xenograft khối u tiền lâm sàng. Do đó, không cần điều chỉnh liều pertuzumab dựa trên các đồng biến này.
Kết quả PK của pertuzumab trong các nghiên cứu NEOSPHERE và APHINITY phù hợp với dự đoán từ mô hình PK dân số trước đó. Không có sự khác biệt về PK pertuzumab được quan sát thấy ở bệnh nhân ung thư vú giai đoạn đầu so với bệnh nhân ung thư vú di căn.
Chỉ định
Ung thư vú sớm
Perjeta được chỉ định để sử dụng kết hợp với trastuzumab và hóa trị liệu trong:
• điều trị tân dược cho bệnh nhân trưởng thành mắc HER2 dương tính, tiến triển cục bộ, viêm hoặc ung thư vú giai đoạn đầu có nguy cơ tái phát cao
• điều trị bổ trợ cho bệnh nhân trưởng thành bị ung thư vú giai đoạn đầu dương tính với HER2 có nguy cơ tái phát cao
Ung thư vú di căn
Perjeta được chỉ định sử dụng kết hợp với trastuzumab và docetaxel ở bệnh nhân trưởng thành bị ung thư vú di căn HER2 dương tính hoặc tái phát cục bộ, những người chưa được điều trị bằng liệu pháp chống HER2 hoặc hóa trị liệu trước đó cho bệnh di căn của họ.
Chống chỉ định
Quá mẫn cảm với hoạt chất hoặc với bất kỳ tá dược nào
Liều và cách dùng
Perjeta sẽ được bác sĩ hoặc y tá tại bệnh viện hoặc phòng khám sử dụng cho bạn.
• Nó được truyền bằng cách nhỏ giọt vào tĩnh mạch (truyền tĩnh mạch) ba tuần một lần.
• Lượng thuốc bạn được cung cấp và thời gian truyền sẽ kéo dài khác nhau đối với Liều đầu tiên và liều sau.
• Số lượng dịch truyền bạn sẽ được cung cấp tùy thuộc vào cách bạn đáp ứng với điều trị và cho dù bạn đang điều trị trước hay sau phẫu thuật (liệu pháp tân dược hay bổ trợ) hoặc cho bệnh đã lan rộng.
• Perjeta được dùng cùng với các phương pháp điều trị ung thư khác (trastuzumab và hóa trị liệu).
Đối với truyền đầu tiên:
• Bạn sẽ được cung cấp 840 mg Perjeta trong hơn 60 phút. Bác sĩ hoặc y tá của bạn sẽ kiểm tra bên tác dụng trong quá trình truyền của bạn và trong 60 phút sau đó.
• Bạn cũng sẽ được dùng trastuzumab và hóa trị. Đối với tất cả các lần tiêm truyền sau, nếu lần tiêm truyền đầu tiên được dung nạp tốt:
• Bạn sẽ được cung cấp 420 mg Perjeta trong vòng 30 đến 60 phút. Bác sĩ hoặc y tá của bạn sẽ kiểm tra cho các tác dụng phụ trong quá trình truyền của bạn và trong 30 đến 60 phút sau đó.
• Bạn cũng sẽ được dùng trastuzumab và hóa trị.
Để biết thêm thông tin về việc dùng trastuzumab và hóa trị liệu (có thể gây ra tác dụng phụ như tốt), vui lòng tham khảo tờ rơi gói cho các sản phẩm này. Nếu bạn có thắc mắc về những thuốc, xin vui lòng hỏi bác sĩ hoặc y tá của bạn.
Nếu bạn quên có Perjeta
Nếu bạn quên hoặc bỏ lỡ cuộc hẹn để nhận Perjeta, hãy đặt cuộc hẹn khác ngay khi khả thi. Nếu đã được 6 tuần trở lên kể từ lần khám cuối cùng của bạn, liều Perjeta cao hơn là 840 mg sẽ là cho bạn.
Nếu bạn ngừng có Perjeta
Đừng ngừng dùng thuốc này mà không nói chuyện với bác sĩ của bạn trước. Điều quan trọng là bạn được cho tất cả các dịch truyền đã được đề nghị.
Nếu bạn có bất kỳ câu hỏi nào về việc sử dụng thuốc này, hãy hỏi bác sĩ hoặc y tá của bạn.
Chú ý đề phòng và thận trọng
Điều trị bằng Perjeta có thể ảnh hưởng đến tim. Nói chuyện với bác sĩ hoặc y tá của bạn trước khi bạn được cho Perjeta:
• Nếu bạn đã từng có vấn đề về tim (như suy tim, điều trị cho bất thường nghiêm trọng nhịp tim, huyết áp cao không kiểm soát được, cơn đau tim gần đây), chức năng tim của bạn sẽ được kiểm tra trước và trong khi điều trị với Perjeta và bác sĩ sẽ chạy xét nghiệm để kiểm tra xem trái tim của bạn đang hoạt động đúng.
• Nếu bạn đã từng gặp vấn đề về tim trong quá trình điều trị trước đó với trastuzumab.
• Nếu bạn đã từng có một loại thuốc hóa trị liệu từ lớp được gọi là anthracyclines, ví dụ: doxorubicin hoặc epirubicin – những loại thuốc này có thể làm hỏng cơ tim và làm tăng nguy cơ vấn đề về tim với Perjeta.
Nếu bất kỳ điều nào ở trên áp dụng cho bạn (hoặc bạn không chắc chắn), hãy nói chuyện với bác sĩ hoặc y tá của bạn trước khi bạn cho Perjeta.
Phản ứng truyền dịch
Phản ứng tiêm truyền, phản ứng dị ứng hoặc phản vệ (dị ứng nghiêm trọng hơn) có thể xảy ra. Bác sĩ của bạn hoặc y tá sẽ kiểm tra tác dụng phụ trong quá trình truyền dịch của bạn và trong 30 đến 60 phút sau đó. Nếu bạn nhận được bất kỳ phản ứng nghiêm trọng, bác sĩ của bạn có thể ngừng điều trị với Perjeta. Rất hiếm khi bệnh nhân tử vong do phản ứng phản vệ trong quá trình truyền Perjeta.
Giảm bạch cầu do sốt (bạch cầu thấp khi bị sốt)
Khi Perjeta được điều trị bằng các phương pháp điều trị ung thư khác (trastuzumab và hóa trị liệu), số lượng các tế bào bạch cầu có thể giảm và sốt (tăng nhiệt độ) có thể phát triển. Nếu bạn bị viêm đường tiêu hóa (ví dụ như đau miệng hoặc tiêu chảy) bạn có thể có nhiều khả năng phát triển tác dụng phụ này.
Bệnh tiêu chảy
Điều trị bằng Perjeta có thể gây tiêu chảy nặng. Tiêu chảy là tình trạng cơ thể bạn sản xuất nhiều phân nước hơn bình thường. Nếu bạn bị tiêu chảy nặng trong khi nhận Điều trị chống ung thư, bác sĩ có thể bắt đầu điều trị chống tiêu chảy và có thể ngăn chặn bạn điều trị bằng Perjeta cho đến khi tiêu chảy được kiểm soát.
Sử dụng ở trẻ em và thanh thiếu niên
Perjeta không nên được trao cho bệnh nhân dưới 18 tuổi vì không có thông tin về làm thế nào nó hoạt động trong nhóm tuổi này.
Mang thai và cho con bú
Trước khi bắt đầu điều trị, bạn phải nói với bác sĩ hoặc y tá nếu bạn đang mang thai hoặc cho con bú, hoặc nếu bạn nghĩ rằng bạn có thể mang thai hoặc đang có kế hoạch sinh con. Họ sẽ tư vấn cho bạn về những lợi ích và rủi ro cho bạn và em bé của bạn khi dùng Perjeta khi bạn đang mang thai.
• Nói với bác sĩ của bạn ngay lập tức, nếu bạn có thai trong khi điều trị với Perjeta hoặc trong khi 6 tháng sau khi ngừng điều trị.
• Hỏi bác sĩ về việc bạn có thể cho con bú trong hoặc sau khi điều trị với Perjeta. Perjeta có thể gây hại cho thai nhi. Bạn nên sử dụng biện pháp tránh thai hiệu quả trong quá trình điều trị với Perjeta và trong 6 tháng sau khi ngừng điều trị. Nói chuyện với bác sĩ của bạn về biện pháp tránh thai tốt nhất cho bạn.
Lái xe và sử dụng máy móc
Perjeta không có khả năng ảnh hưởng đến việc bạn có thể lái xe hoặc sử dụng máy móc. Tuy nhiên, nếu bạn nhận được bất kỳ truyền dịch phản ứng, phản ứng dị ứng hoặc phản vệ, đợi cho đến khi chúng biến mất trước khi lái xe hoặc sử dụng máy móc.
Tương tác thuốc
Hãy cho bác sĩ hoặc y tá của bạn nếu bạn đang dùng, gần đây đã uống hoặc có thể dùng bất kỳ loại thuốc nào khác.
Tác dụng không mong muốn
Tác dụng phụ nghiêm trọng
Nói cho bác sĩ hoặc y tá ngay lập tức, nếu bạn nhận thấy bất kỳ tác dụng phụ nào sau đây:
• Tiêu chảy rất nặng hoặc kéo dài (7 phân trở lên mỗi ngày).
• Giảm số lượng hoặc số lượng bạch cầu thấp (thể hiện trong xét nghiệm máu), với hoặc không sốt, có thể làm tăng nguy cơ nhiễm trùng.
• Phản ứng truyền dịch với các triệu chứng có thể nhẹ hoặc nặng hơn và có thể bao gồm cảm thấy ốm (buồn nôn), sốt, ớn lạnh, cảm thấy mệt mỏi, đau đầu, chán ăn, khớp và cơ bắp đau, và nóng bừng.
• Phản ứng dị ứng và phản vệ (dị ứng nặng hơn) với các triệu chứng có thể bao gồm sưng mặt và cổ họng, khó thở. Rất hiếm khi bệnh nhân tử vong
do phản ứng phản vệ trong quá trình truyền Perjeta.
• Các vấn đề về tim (suy tim) với các triệu chứng có thể bao gồm ho, khó thở và sưng (giữ nước) ở chân hoặc cánh tay của bạn.
• Hội chứng ly giải khối u (một tình trạng có thể xảy ra khi các tế bào ung thư chết nhanh chóng, gây ra sự thay đổi nồng độ khoáng chất và chất chuyển hóa trong máu được thể hiện trong xét nghiệm máu). Triệu chứng có thể bao gồm các vấn đề về thận (yếu, khó thở, mệt mỏi và nhầm lẫn), tim các vấn đề (rung tim của nhịp tim nhanh hơn hoặc chậm hơn), co giật, nôn mửa hoặc tiêu chảy và ngứa ran ở miệng, tay hoặc chân
Nói với bác sĩ hoặc y tá ngay lập tức, nếu bạn nhận thấy bất kỳ tác dụng phụ nào ở trên.
Các tác dụng phụ rất phổ biến (có thể ảnh hưởng đến hơn 1 trên 10 người):
• Bệnh tiêu chảy
• Rụng tóc
• Cảm thấy mệt mỏi hoặc mệt mỏi
• Phát ban
• Viêm đường tiêu hóa của bạn (ví dụ như đau miệng)
• Giảm số lượng tế bào hồng cầu – thể hiện trong xét nghiệm máu
• Đau khớp hoặc cơ, yếu cơ
• Táo bón
• Giảm sự thèm ăn
• Mất hoặc thay đổi hương vị
• Sốt
• Mắt cá chân bị sưng hoặc các bộ phận cơ thể khác do cơ thể bạn giữ quá nhiều nước
• Không ngủ được
• Nóng bừng
• Cảm giác yếu, tê, ngứa ran hoặc châm chích chủ yếu ảnh hưởng đến bàn chân và chân
• Chảy máu mũi
• Ho
• Chứng ợ nóng
• Khô, ngứa hoặc nổi mụn như da
• Vấn đề về móng
• Đau họng, đỏ, đau hoặc sổ mũi, các triệu chứng giống như cúm và sốt
• Sản xuất nhiều nước mắt
• Sốt liên quan đến mức độ nguy hiểm của một loại tế bào bạch cầu (bạch cầu trung tính)
• Đau ở cơ thể, cánh tay, chân và bụng
• Khó thở
• Cảm thấy chóng mặt
Thường gặp (có thể ảnh hưởng đến 1 trên 10 người):
• Cảm giác tê, châm chích hoặc ngứa ran ở bàn chân hoặc bàn tay; đâm mạnh, nhói, đau đóng băng hoặc đau rát; cảm thấy đau từ một cái gì đó không nên đau đớn như chạm nhẹ; ít có khả năng cảm thấy những thay đổi trong nóng hoặc lạnh; mất thăng bằng hoặc phối hợp
• Viêm móng giường nơi móng tay và da gặp nhau
• Tình trạng tâm thất trái của tim bị suy giảm chức năng có hoặc không có triệu chứng
Không phổ biến (có thể ảnh hưởng đến 1 trên 100 người):
• Các triệu chứng ở ngực như ho khan hoặc khó thở (có thể là dấu hiệu của phổi kẽ bệnh, một tình trạng tổn thương các mô xung quanh túi khí trong phổi)
• Chất lỏng xung quanh phổi gây khó thở
Nếu bạn gặp bất kỳ triệu chứng nào ở trên sau khi điều trị bằng Perjeta đã được dừng lại, bạn nên tham khảo ý kiến bác sĩ ngay lập tức và thông báo cho họ rằng bạn đã được điều trị trước đó với Perjeta.
Một số tác dụng phụ mà bạn nhận được có thể là do ung thư vú. Nếu bạn được tặng Perjeta với trastuzumab và hóa trị cùng một lúc, một số tác dụng phụ cũng có thể là do những thứ khác thuốc men.
Quá liều
Liều pertuzumab dung nạp tối đa chưa được xác định. Trong các thử nghiệm lâm sàng, liều duy nhất cao hơn 25 mg / kg (1727 mg) chưa được thử nghiệm.
Trong trường hợp quá liều, bệnh nhân phải được theo dõi chặt chẽ các dấu hiệu hoặc triệu chứng của phản ứng bất lợi và điều trị triệu chứng thích hợp được đưa ra.
Bảo quản
Lưu trữ trong tủ lạnh (2 ° C-8 ° C).
Không đóng băng.
Giữ lọ trong thùng carton để tránh ánh sáng.