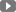Mục lục
Polivy được chỉ định, đưa ra và theo dõi bởi một chuyên gia chăm sóc sức khỏe có kinh nghiệm trong điều trị bệnh cho bệnh nhân ung thư.
Dạng trình bày
Bột Polivy 140 mg để cô đặc cho dung dịch tiêm truyền.
Dạng đăng kí
Thuốc kê đơn
Thành phần
Mỗi lọ bột cô đặc cho dung dịch tiêm truyền chứa 140 mg polatuzumab vedotin.
Sau khi phục hồi, mỗi mL chứa 20 mg polatuzumab vedotin.
Polatuzumab vedotin là một liên hợp kháng thể-thuốc bao gồm các tác nhân chống phân bào monomethyl auristatin E (MMAE) liên kết cộng hóa trị với một kháng thể đơn dòng hướng CD79b (tế bào miễn dịch tái tổ hợp nhân tạo bằng CD79b (IgG1].
Dược lực học
Cơ chế hoạt động
Polatuzumab vedotin là một liên hợp kháng thể-thuốc nhắm mục tiêu CD79b, tốt nhất là cung cấp một chất chống phân bào mạnh (monomethyl auristatin E, hoặc MMAE) cho các tế bào B, dẫn đến việc tiêu diệt các tế bào B ác tính. Phân tử polatuzumab vedotin bao gồm MMAE liên kết cộng hóa trị với một kháng thể đơn dòng immunoglobulin G1 được nhân hóa thông qua một liên kết có thể tách rời.
Kháng thể đơn dòng liên kết với ái lực cao và chọn lọc với CD79b, một thành phần bề mặt tế bào của thụ thể tế bào B. Biểu hiện CD79b bị giới hạn ở các tế bào bình thường trong dòng tế bào B (ngoại trừ tế bào plasma) và tế bào B ác tính; nó được biểu hiện ở> 95% u lympho tế bào B khuếch tán lớn. Khi liên kết với CD79b, polatuzumab vedotin nhanh chóng được nội hóa và trình liên kết được cắt bởi các protease lysosomal để cho phép phân phối MMAE nội bào.
Tác dụng dược lực học
Điện sinh lý tim
Polatuzumab vedotin không kéo dài khoảng QTc trung bình đến bất kỳ mức độ phù hợp lâm sàng nào dựa trên dữ liệu ECG từ hai nghiên cứu nhãn mở ở bệnh nhân có khối u ác tính tế bào B được điều trị trước đó với liều khuyến cáo.
Dược động học
Phơi nhiễm huyết tương MMAE (acMMAE) kết hợp kháng thể tăng liều theo tỷ lệ tương ứng trong khoảng liều 0,1 đến 2,4 mg / kg polatuzumab vedotin. Sau liều vedotin 1,8 mg / kg đầu tiên, nồng độ tối đa trung bình của acMMAE (C max ) là 803 (± 233) ng / mL và vùng dưới đường cong nồng độ theo thời gian từ 0 đến vô cùng (AUC inf) là 1860 (± 966) ngày • ng / mL. Dựa trên phân tích PK dân số, chu kỳ 3 acMMAE AUC tăng khoảng 30% so với chu kỳ 1 AUC và đạt được hơn 90% của chu kỳ 6 AUC. Thời gian bán hủy của thiết bị đầu cuối ở Chu kỳ 6 là khoảng 12 ngày (95% CI là 8.1-19.5 ngày) đối với acMMAE. Dựa trên phân tích PK dân số, nồng độ acMMAE dự đoán ở cuối chu kỳ 6 là khoảng 80% giá trị trạng thái ổn định lý thuyết.
Phơi nhiễm MMAE không liên hợp, thành phần gây độc tế bào của polatuzumab vedotin, tăng liều theo tỷ lệ trong khoảng liều 0,1 đến 2,4 mg / kg polatuzumab vedotin. Nồng độ MMAE theo sau động lực học giới hạn tỷ lệ hình thành. Sau liều vedotin 1,8 mg / kg đầu tiên, tối đa Clà 6,82 (± 4,73) ng / mL, thời gian để nồng độ tối đa trong huyết tương là khoảng 2,5 ngày và thời gian bán hủy ở giai đoạn cuối là khoảng 4 ngày. Phơi nhiễm huyết tương của MMAE không liên hợp là <3% phơi nhiễm acMMAE. Dựa trên phân tích PK dân số, có sự giảm phơi nhiễm MMAE không liên hợp trong huyết tương (AUC) sau khi lặp lại liều mỗi ba tuần.
Dựa trên các mô phỏng dược động học dân số, một phân tích độ nhạy dự đoán phơi nhiễm MMAE không liên hợp cho bệnh nhân có trọng lượng cơ thể trên 100 kg sẽ tăng 27%.
Hấp thu
Polivy được dùng dưới dạng tiêm truyền tĩnh mạch. Không có nghiên cứu được thực hiện với các tuyến hành chính khác.
Phân bố
Ước tính dân số của thể tích phân phối trung tâm cho acMMAE là 3,15 L, tương đương với thể tích huyết tương . Trong ống nghiệm , MMAE liên kết vừa phải (71% -77%) với protein huyết tương của người. MMAE không phân vùng đáng kể vào các tế bào hồng cầu của người trong ống nghiệm ; tỷ lệ máu / huyết tương là 0,79 đến 0,98.
Dữ liệu in vitro chỉ ra rằng MMAE là chất nền P-gp nhưng không ức chế P-gp ở nồng độ phù hợp lâm sàng.
Biến đổi sinh học
Polatuzumab vedotin dự kiến sẽ trải qua quá trình dị hóa ở bệnh nhân, dẫn đến việc sản xuất các peptide nhỏ, axit amin, MMAE không liên hợp và dị hóa MMAE không liên hợp. Nồng độ các chất chuyển hóa MMAE chưa được đo trong huyết tương người.
Các nghiên cứu in vitro chỉ ra rằng MMAE là chất nền cho CYP3A4 / 5 nhưng không tạo ra các enzyme CYP chính. MMAE là một chất ức chế phụ thuộc thời gian yếu của CYP3A4 / 5 nhưng không ức chế cạnh tranh CYP3A4 / 5 ở nồng độ phù hợp lâm sàng.
MMAE không ức chế CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19 hoặc CYP2D6.
Thải trừ
Dựa trên phân tích PK dân số, liên hợp (acMMAE) chủ yếu được loại bỏ bằng con đường giải phóng tuyến tính không đặc hiệu với giá trị 0,9 L / ngày. Các nghiên cứu in vivo trên chuột được điều trị bằng polatuzumab vedotin (radiolabel trên MMAE) chứng minh rằng phần lớn phóng xạ được bài tiết qua phân và thiểu số phóng xạ được bài tiết qua nước tiểu.
Trẻ em
Không có nghiên cứu nào được thực hiện để điều tra dược động học của polatuzumab vedotin trong dân số nhi khoa (<18 tuổi).
Người cao tuổi
Tuổi không có ảnh hưởng đến dược động học của acMMAE và MMAE không liên hợp dựa trên phân tích PK dân số với bệnh nhân từ 20-89 tuổi. Không có sự khác biệt đáng kể đã được quan sát trong dược động học của acMMAE và MMAE không liên hợp ở những bệnh nhân <65 tuổi (n = 187) và bệnh nhân ≥ 65 tuổi (n = 273).
Suy thận
Ở những bệnh nhân bị suy thận nhẹ (CrCL 60-89 mL / phút, n = 161) hoặc trung bình (CrCL 30- 59 mL / phút, n = 109), phơi nhiễm acMMAE và MMAE không liên hợp tương tự như bệnh nhân có chức năng thận bình thường (CrCL 90 mL / phút, n = 185), dựa trên phân tích PK dân số. Không đủ dữ liệu để đánh giá tác động của suy thận nặng (CrCL 15-29 mL / phút, n = 3) trên PK. Không có dữ liệu có sẵn ở những bệnh nhân mắc bệnh thận giai đoạn cuối và / hoặc những người đang chạy thận nhân tạo.
Suy gan
Ở những bệnh nhân bị suy gan nhẹ [AST hoặc ALT> 1.0 đến 2.5 × ULN hoặc tổng số bilirubin> 1.0 đến 1.5 × ULN], n = 54], phơi nhiễm acMMAE tương tự nhau trong khi MMAE AUC không liên hợp cao hơn 40% so với bệnh nhân mắc bệnh gan bình thường hàm (n = 399), dựa trên phân tích PK dân số.
Không đủ dữ liệu để đánh giá tác động của suy gan trung bình (tổng lượng bilirubin> 1,5-3 × ULN, n = 2) trên PK. Không có dữ liệu có sẵn ở những bệnh nhân bị suy gan nặng hoặc ghép gan.
Chỉ định
Polivy kết hợp với bentamamineine và rituximab được chỉ định để điều trị cho bệnh nhân trưởng thành bị u lympho tế bào B lớn tái phát / khúc xạ (DLBCL) không phải là ứng cử viên cho ghép tế bào gốc tạo máu.
Chống chỉ định
Quá mẫn cảm với hoạt chất hoặc với bất kỳ tá dược nào
Nhiễm trùng nặng hoạt động
Liều và cách dùng
Polivy được đưa ra dưới sự giám sát của một bác sĩ có kinh nghiệm trong việc đưa ra phương pháp điều trị như vậy. Nó được đưa vào tĩnh mạch, nhỏ giọt hơn 90 phút.
Liều lượng của thuốc này phụ thuộc vào trọng lượng cơ thể của bạn.
• Liều khởi đầu thông thường là 1,8 mg cho mỗi kg trọng lượng cơ thể của bạn.
• Nếu bạn bị bệnh thần kinh ngoại biên, bác sĩ có thể giảm liều của bạn xuống 1,4 mg cho mỗi kg trọng lượng cơ thể của bạn.
Bạn sẽ được điều trị 6 chu kỳ điều trị Polivy kết hợp với hai loại thuốc khác gọi là rituximab và uốn cong.
Mỗi chu kỳ kéo dài 21 ngày.
Nếu bạn bỏ lỡ một liều Polivy
Nếu bạn bỏ lỡ một cuộc hẹn, hãy thực hiện một cuộc hẹn khác ngay lập tức. Để việc điều trị có hiệu quả hoàn toàn, nó là rất quan trọng để không bỏ lỡ một liều.
Nếu bạn ngừng nhận Polivy
Đừng ngừng điều trị với Polivy trừ khi bạn đã thảo luận điều này với bác sĩ của bạn. Đây là vì
Ngừng điều trị có thể làm cho tình trạng của bạn tồi tệ hơn.
Nếu bạn có bất kỳ câu hỏi nào về việc sử dụng thuốc này, hãy hỏi bác sĩ hoặc y tá của bạn
Chú ý đề phòng và thận trọng
Nói chuyện với bác sĩ hoặc y tá của bạn trước khi bạn được cho Polivy nếu bất kỳ điều nào sau đây áp dụng cho bạn (hoặc bạn không chắc chắn):
• bạn đã từng gặp các vấn đề về não hoặc thần kinh như:
– vấn đề bộ nhớ
– khó di chuyển hoặc cảm giác trong cơ thể bạn như cảm giác ghim và kim, nóng rát, đau và khó chịu ngay cả khi chạm nhẹ
– vấn đề về thị lực
• bạn đã từng có vấn đề về gan
• bạn nghĩ rằng bạn bị nhiễm trùng hoặc đã bị nhiễm trùng kéo dài hoặc lặp đi lặp lại như herpes
• bạn chuẩn bị tiêm vắc-xin hoặc bạn biết rằng bạn có thể cần phải tiêm vắc-xin trong tương lai gần
Nếu bất kỳ điều nào ở trên áp dụng cho bạn (hoặc bạn không chắc chắn) hãy nói chuyện với bác sĩ hoặc y tá của bạn trước khi bạn được sử dụng Polivy
Chú ý đến các tác dụng phụ sau
Polivy có thể gây ra một số tác dụng phụ nghiêm trọng mà bạn cần nói với bác sĩ hoặc y tá của bạn:
Ức chế tủy
Ức chế tủy là tình trạng sản xuất tế bào máu bị giảm, dẫn đến ít hơn hồng cầu, bạch cầu và tiểu cầu. Bác sĩ sẽ làm xét nghiệm máu để kiểm tra máu của bạn số lượng tế bào.
Hãy cho bác sĩ hoặc y tá của bạn ngay lập tức nếu bạn:
• ớn lạnh hoặc run rẩy
• bị sốt
• đau đầu
• cảm thấy mệt mỏi
• cảm thấy chóng mặt
• Trông nhợt nhạt
• chảy máu bất thường, bầm tím dưới da, chảy máu lâu hơn bình thường sau khi máu của bạn có được rút ra, hoặc chảy máu từ nướu của bạn.
Bệnh lý thần kinh ngoại biên
Hãy cho bác sĩ hoặc y tá của bạn ngay lập tức nếu bạn có bất kỳ vấn đề nào với sự thay đổi độ nhạy cảm của da của bạn, đặc biệt là ở tay hoặc chân, chẳng hạn như:
• tê
• ngứa ran
• cảm giác nóng rát
• đau đớn
• khó chịu hoặc yếu đuối.
Nếu bạn có bất kỳ triệu chứng nào trước khi điều trị bằng Polivy, hãy báo ngay cho bác sĩ nếu bạn nhận thấy bất kỳ thay đổi trong chúng.
Nếu bạn có các triệu chứng của bệnh thần kinh ngoại biên, bác sĩ có thể giảm liều của bạn.
Nhiễm trùng
Các dấu hiệu và triệu chứng nhiễm trùng khác nhau giữa các cá nhân, hãy báo ngay cho bác sĩ hoặc y tá của bạn nếu bạn phát triển các triệu chứng của nhiễm trùng như:
• sốt
• ho
• tưc ngực
• mệt mỏi
• phát ban đau đớn
• đau họng
• đau rát khi đi tiểu
• cảm thấy yếu hoặc thường không khỏe.
Bệnh não chất trắng đa ổ tiến triển (PML)
PML là một bệnh nhiễm trùng rất hiếm gặp và đe dọa đến tính mạng trong não, xảy ra ở một bệnh nhân được điều trị với Polivy cùng với bentamamine và một loại thuốc khác gọi là obinutuzumab.
Hãy cho bác sĩ hoặc y tá của bạn ngay lập tức nếu bạn có:
• mất trí nhớ
• khó nói
• đi lại khó khăn
• vấn đề với thị lực của bạn.
Nếu bạn có bất kỳ triệu chứng nào trước khi điều trị bằng Polivy, hãy báo ngay cho bác sĩ nếu bạn nhận thấy bất kỳ thay đổi trong chúng. Bạn có thể cần điều trị y tế.
Hội chứng ly giải khối u
Một số người có thể phát triển mức độ bất thường của một số chất (như kali và axit uric) trong máu gây ra bởi sự phá vỡ nhanh chóng của các tế bào ung thư trong quá trình điều trị. Điều này được gọi là ly giải khối u hội chứng. Bác sĩ, dược sĩ hoặc y tá của bạn sẽ làm xét nghiệm máu để kiểm tra tình trạng.
Phản ứng liên quan đến truyền dịch
Phản ứng liên quan đến truyền dịch, phản ứng dị ứng hoặc phản vệ (dị ứng nghiêm trọng hơn) có thể xảy ra. Của bạn bác sĩ hoặc y tá sẽ kiểm tra tác dụng phụ trong quá trình truyền dịch của bạn và trong 30 đến 90 phút sau đó. Nếu bạn nhận được bất kỳ phản ứng nghiêm trọng, bác sĩ của bạn có thể ngừng điều trị với Polivy.
Tổn thương gan
Thuốc này có thể gây viêm hoặc tổn thương các tế bào trong gan ảnh hưởng đến chức năng bình thường của gan. Các tế bào gan bị thương có thể rò rỉ một lượng lớn các chất nhất định (men gan và bilirubin) vào máu, trong đó có thể được phát hiện bằng xét nghiệm máu. Trong hầu hết các trường hợp, bạn sẽ không có bất kỳ triệu chứng nào nhưng hãy nói ngay với bác sĩ hoặc y tá nếu bạn • vàng da và tròng trắng mắt (vàng da).
Bác sĩ sẽ kiểm tra máu của bạn để kiểm tra chức năng gan của bạn trước và thường xuyên trong quá trình điều trị.
Trẻ em và thanh thiếu niên
Thuốc này không nên được sử dụng ở trẻ em hoặc người trẻ dưới 18 tuổi. Điều này là do không có thông tin về việc sử dụng nó trong nhóm tuổi này.
Thuốc khác và Polivy
Hãy cho bác sĩ hoặc y tá của bạn nếu bạn đang dùng, gần đây đã uống hoặc có thể bắt đầu dùng bất kỳ loại nào khác thuốc men. Điều này bao gồm các loại thuốc thu được mà không cần toa và thuốc thảo dược.
Tránh thai (phụ nữ và nam giới)
Nếu bạn là phụ nữ trong độ tuổi sinh đẻ, bạn phải sử dụng biện pháp tránh thai hiệu quả trong quá trình điều trị và cho 9 tháng sau liều Polivy cuối cùng.
Đàn ông phải sử dụng biện pháp tránh thai trong khi điều trị và trong 6 tháng sau liều Polivy cuối cùng.
Thai kỳ
Điều quan trọng là nói với bác sĩ của bạn trước và trong khi điều trị nếu bạn đang mang thai, nghĩ rằng bạn có thể đang mang thai, hoặc đang có kế hoạch mang thai. Điều này là do Polivy có thể ảnh hưởng đến sức khỏe của bạn. Bạn không nên sử dụng thuốc này nếu bạn đang mang thai trừ khi bạn và bác sĩ quyết định rằng lợi ích cho bạn lớn hơn nguy cơ có thể xảy ra với thai nhi.
Cho con bú
Không cho con bú trong khi nhận Polivy vì một lượng nhỏ Polivy có thể đi vào sữa.
Khả năng sinh sản
Đàn ông đang điều trị bằng thuốc này được khuyên nên bảo quản và lưu trữ mẫu tinh trùng trước sự đối xử.
Lái xe và sử dụng máy móc
Polivy có ảnh hưởng nhỏ đến khả năng lái xe, đạp xe hoặc sử dụng bất kỳ công cụ hoặc máy móc nào của bạn. Nếu bạn nhận được phản ứng liên quan đến truyền dịch hoặc tổn thương thần kinh, hoặc nếu bạn cảm thấy mệt mỏi, yếu hoặc chóng mặt thì không lái xe, chu kỳ hoặc sử dụng các công cụ hoặc máy móc cho đến khi phản ứng dừng lại.
Tương tác thuốc
Tương tác thuốc với thuốc đồng thời là thuốc ức chế CYP3A4, chất nền hoặc thuốc gây cảm ứng và thuốc đồng thời là thuốc ức chế P-gp
Dựa trên mô phỏng mô hình dược động học dựa trên sinh lý (PBPK) của MMAE được phát hành từ polatuzumab vedotin, các chất ức chế CYP3A4 và P-gp mạnh (ví dụ, ketoconazole) có thể làm tăng diện tích theo đường cong thời gian tập trung (AUC). Cần thận trọng trong trường hợp điều trị đồng thời với thuốc ức chế CYP3A4. Bệnh nhân đang dùng thuốc ức chế CYP3A4 mạnh đồng thời (ví dụ: boceprevir, clarithromycin, cobicistat, indinavir, itraconazole, nefazodone, nelfinavir, posaconazole, ritonavir, saquinavir, telap
MMAE không liên hợp không được dự đoán sẽ làm thay đổi AUC của các thuốc đồng thời là chất nền CYP3A4 (ví dụ midazolam).
Các chất gây cảm ứng CYP3A4 mạnh (ví dụ: rifampicin, carbamazepine, phenobarbital, phenytoin, St John’s wort [ Hypericum perforatum ]) có thể làm giảm sự phơi nhiễm của MMAE không liên hợp.
Tương tác thuốc của rituximab và bentamustine kết hợp với polatuzumab vedotin
Dược động học (PK) của rituximab và bentamustine không bị ảnh hưởng bởi việc dùng chung với polatuzumab vedotin. Rituximab đồng thời có liên quan đến tăng AUC huyết tương kết hợp kháng thể MMAE (acMMAE) tăng 24% và giảm AUC huyết tương MMAE không liên hợp xuống 37%, dựa trên phân tích PK dân số. Không cần điều chỉnh liều.
Bendamustine không ảnh hưởng đến acMMAE và AUC huyết tương không kết hợp.
Tác dụng không mong muốn
Tác dụng phụ nghiêm trọng
Hãy cho bác sĩ hoặc y tá của bạn ngay lập tức nếu bạn nhận thấy bất kỳ tác dụng phụ nghiêm trọng nào sau đây – bạn có thể cần điều trị y tế khẩn cấp. Đây có thể là những triệu chứng mới hoặc thay đổi hiện tại của bạn triệu chứng.
• sốt và ớn lạnh
• phát ban / nổi mề đay
• nhiễm trùng nặng
• viêm phổi (nhiễm trùng phổi)
• nhiễm herpes
• nhiễm virus
• chảy máu bất thường hoặc bầm tím dưới da
• Mất trí nhớ, khó nói, đi lại khó khăn hoặc gặp vấn đề với thị lực của bạn
• vàng da hoặc tròng trắng mắt
Tác dụng phụ khác
Hãy cho bác sĩ hoặc y tá của bạn nếu bạn nhận thấy bất kỳ tác dụng phụ nào sau đây:
Rất phổ biến (có thể ảnh hưởng đến hơn 1 trên 10 người)
• sốt hoặc ớn lạnh
• ho
• nôn
• viêm phổi (nhiễm trùng phổi)
• tiêu chảy hoặc táo bón
• cảm thấy ốm (buồn nôn)
• đau bụng (bụng)
• cảm thấy mệt mỏi (thiếu máu)
• không cảm thấy đói
• ngứa
• giảm cân
• phản ứng liên quan đến truyền dịch
• cảm lạnh thông thường
• nhiễm herpes
• chóng mặt
• cảm giác bất thường
Chung
• nhiễm trùng nặng
• nhiễm virus
• vấn đề đi bộ
• viêm phổi
• men gan
• đau khớp
Quá liều
Không có kinh nghiệm về quá liều trong các thử nghiệm lâm sàng ở người. Liều cao nhất được thử nghiệm cho đến nay là 2,4 mg / kg dùng dưới dạng tiêm truyền tĩnh mạch; nó có liên quan đến tần suất cao hơn và mức độ nghiêm trọng của các sự kiện PN. Bệnh nhân bị quá liều nên được ngừng truyền ngay lập tức và được theo dõi chặt chẽ.
Bảo quản
Lưu trữ trong tủ lạnh (2 ° C – 8 ° C).
Không đóng băng.
Giữ lọ trong thùng carton để tránh ánh sáng